Forschungsbericht 2012 - Max-Planck-Institut für Biologie Tübingen
Die Evolution von AAA ATPase-Nanomaschinen zur Regulierung des Proteinabbaus
Qualitätskontrolle von Proteinen in der Zelle
Die definierte dreidimensionale Struktur der Proteine, die sich aus ihrer Aminosäuresequenz ergibt, bedingt ihre spezifische Funktion. Nach Synthese in der Zelle ist die Faltung der Polypeptidkette in die jeweilige Proteinstruktur zwar ein energetisch spontaner Prozess, der allerdings nicht immer reibungslos vonstattengeht. Es treten immer wieder Fehler auf, die zu falsch gefalteten Proteinen und Proteinaggregaten führen können. Um die Ansammlung solch toxischer Aggregate zu verhindern, verfügen Organismen über ein ausgeklügeltes System zur Proteinqualitätskontrolle. Sie haben eigens für die Proteinfaltung Helferfaktoren evolviert, sogenannte Chaperone. Gelingt es aber trotz ihrer Mithilfe nicht, ein Protein auch nach mehreren Anläufen korrekt zu falten, bleibt als ultimative Möglichkeit nur noch ein kontrollierter Abbau durch Proteasen. Schlägt auch dieser fehl, zum Beispiel weil das korrekte Zusammenspiel der zellulären Mechanismen in einem Organismus altersbedingt nachlässt, so kann die vermehrte Bildung und Akkumulation toxischer Aggregate zu Zelltod oder zu Erkrankungen führen, beim Menschen beispielsweise Morbus Alzheimer oder Morbus Parkinson.
Doch auch für völlig intakte Proteine kann die Stunde schlagen: Entwickelt sich ein Organismus oder ändern sich Wachstumsbedingungen und Zellzyklus oder differenzieren sich Zellen und Gewebe, so hat dies zur Folge, dass bestimmte Proteine nicht mehr benötigt oder plötzlich sogar unerwünscht sind. Resultat: Sie werden einem Abbau unterworfen. Woher „wissen“ aber nun die Proteasen in der Zelle, welche Proteine sie gerade entfernen sollen und welche besser nicht? Forschungsergebnisse der vergangenen Jahre haben gezeigt, dass wenn eine Protease an ein Protein andockt, diese Entscheidung schon längst gefallen ist.
Energie im Ring: AAA ATPasen bringen Proteine zur Entfaltung
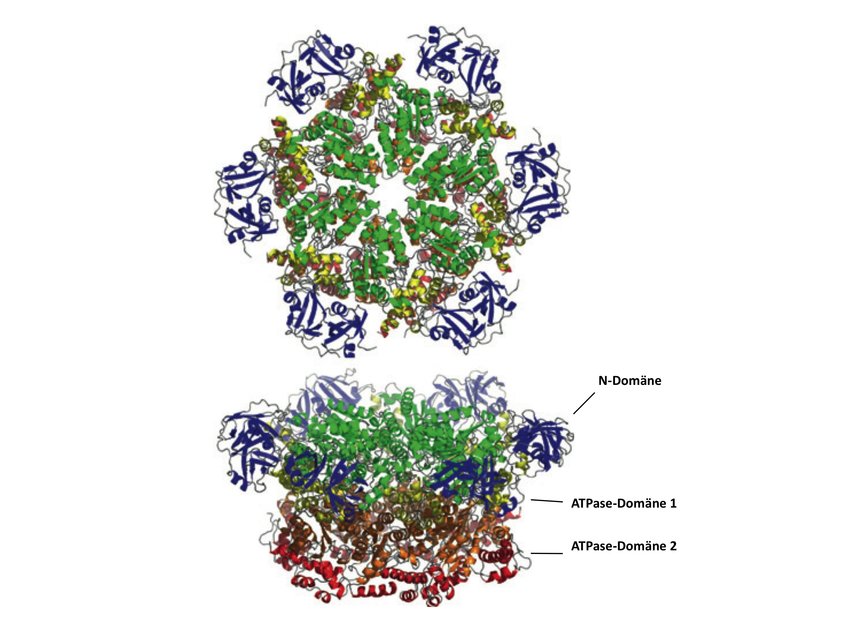
Proteasen können in der Regel nur entfaltete Proteine abbauen. Um potenzielle Proteolysekandidaten zu entfalten, wird aber Energie benötigt. Hier kommen AAA ATPasen ins Spiel: Sie liefern chemische Energie in Form von ATP-Hydrolyse, was eine Strukturänderung der ATPase zur Folge hat. Als mechanische Energie überträgt sich dies auf die von der ATPase gebundenen Proteine, also die Abbaukandidaten, was wiederum zu deren Entfaltung führt. Da eine mindestens partielle Entfaltung von Proteinen oder gegebenenfalls reversible Dissoziation von Proteinkomplexen nicht nur beim Abbau, sondern auch bei einer Vielzahl anderer zellulärer Vorgänge vonnöten ist, spielen AAA ATPasen folglich eine zentrale Rolle im Zellgeschehen [1], und daraus resultiert auch ihr Name: ATPases Associated with diverse cellular Activities. Sie bilden hexamere Ringe, denen jede Untereinheit aus einer Substratbindedomäne (N-Domäne) besteht, gefolgt von einer oder zwei ATPase-Domänen (Abb. 1).

Die Aminosäuresequenzen der ATPase-Domänen erlauben eine phylogenetische Klassifizierung der AAA ATPasen in Unterfamilien [2], jedoch sind es die verschiedenen N-Domänen, die als Hauptunterscheidungsmerkmal ins Auge fallen (Abb. 2). Die strukturelle Vielfalt der N-Domänen wurde extensiv analysiert und es konnte gezeigt werden, dass sie es sind, die die initiale Binding von Proteinen verantworten [3, 4]: Aufgrund ihrer heterogenen Strukturen bedingen die N-Domänen die unterschiedlichen Substratspezifitäten von AAA ATPasen in einer Zelle.
Es gibt zwei prinzipielle Möglichkeiten, wie AAA ATPasen ihre Substrate auswählen: Ein falsch gefaltetes Protein kann direkt erkannt werden anhand bestimmter Eigenschaften, die es von korrekt gefalteten Proteinen unterscheidet, zum Beispiel hydrophobe Oberflächen oder extendierte Aminosäureketten. Oder aber an sich korrekt gefaltete Proteine sind kovalent mit einem Erkennungslabel versehen, das sie als zum Abbau freigegeben markiert und zu AAA ATPasen hinleitet. In Eukaryonten bestehen diese Label typischerweise aus Polyubiquitinketten, in Bakterien und Archaeen aus anders gearteten Modifizierungen - Pupylierung, SAMPylierung -, deren Wirkungsweise noch weiterer Untersuchungen bedarf.

Nachdem Zyklen von ATP-Hydrolyse Strukturänderungen in der ATPase ausgelöst haben, die in der Entfaltung der assoziierten Proteine resultieren, werden diese als extendierte Polypeptidketten in die schmale zentrale Öffnung des ATPase-Rings eingefädelt. Sie durchlaufen den Ring und gelangen dann jenseitig wieder an die Oberfläche – bereit zum Abbau.
Abbau im Zylinder: Proteasomen und die Evolution von Protein-Nanomaschinen
AAA ATPasen kooperieren mit dem Proteasom, der wohl wichtigsten intrazellulären Protease in Eukaryonten und Archaeen. Die zylindrische Nanomaschine besteht aus vier gestapelten Ringen, wobei die äußeren Ringe für die Interaktion mit AAA ATPasen zuständig sind und die zentralen Ringe die Proteaseaktivität beinhalten. Ihr aktives Zentrum weist ins abgeschirmte Ringinnere: So wird zusätzlich verhindert, dass intakte funktionelle Proteine nicht unbeabsichtigt und zufällig abgebaut werden, sondern eleganterweise nur diejenigen Proteine zum Abbau gelangen, die zuvor von AAA ATPasen selektiert, entfaltet und in das Proteasom geleitet wurden.

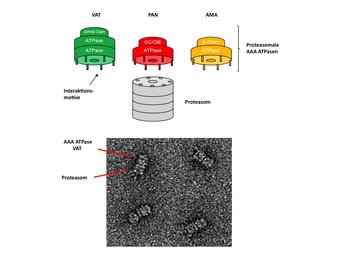
Eine Kernfrage der letzten Jahre war, wie die Übertragung der entfalteten Aminosäurekette von der AAA ATPase in das Proteasom möglich ist, ohne dass sich das Protein zwischenzeitlich wieder auffaltet. Es stellte sich heraus, dass die mit Proteasomen interagierenden AAA ATPasen an ihrem Ende ein charakteristisches kurzes Sequenzmotiv besitzen, das von den Untereinheiten im äußeren Proteasomring erkannt wird. Auf diese Weise können ATPase und Proteasom nahtlos aneinander andocken. Bisher war als Zulieferer in Archaeen nur eine einzige AAA ATPase und in Eukaryonten eine Gruppe damit eng verwandter Proteine bekannt. Biochemische und bioinformatische Arbeiten der Abteilung Proteinevolution konnten jetzt allerdings zeigen, dass in Archaeen ein mit dem Proteasom kooperierendes Netzwerk verschiedener AAA ATPasen existiert (Abb. 3, [5]). Sequenzanalysen ergaben, dass die kooperierenden AAA ATPasen einerseits Varianten des konservierten Interaktionsmotivs besitzen, andererseits gleichzeitig aber gänzlich verschiedene N-Domänen haben. Die Vermutung liegt nahe, dass Zellen und Organismen auf diese Weise ein breiteres Spektrum an Substratproteinen verarbeiten können und daher gegebenenfalls auch eine differenzierte räumliche und zeitliche Regulierung dieses Prozesses ermöglichen. Überraschenderweise fanden sich bei der Charakterisierung archaealer AAA ATPasen auch enge Verwandte, denen - obwohl sonst nahezu identisch - das Sequenzmotiv fehlt und die scheinbar nicht selbst mit dem Proteasom interagieren. Die Aufklärung ihrer bislang unbekannten Funktion dürfte aufschlussreiche Erkenntnisse zur Evolution der Familie der AAA ATPasen geben.
FtsH: Entfaltung und Abbau all in one
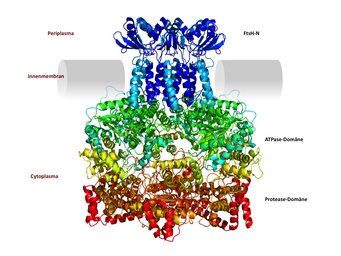
Das oben beschriebene System findet sich sowohl bei Eukaryonten als auch Archaeen. Bakterien hingegen besitzen zwar in der Regel kein Proteasom, verwenden aber gleichwohl ein äquivalentes Prinzip aus AAA ATPasen und ringförmiger Protease. Eine auf den ersten Blick ungewöhnliche bakterielle Variante, die ebenfalls in der Abteilung Proteinevolution untersucht wird, ist FtsH. Diese Nanomaschine ist ein Beispiel für eine AAA ATPase mit dualer Funktion: Sie verfügt über eine integrierte Proteasedomäne, sodass entfaltete Aminosäureketten unmittelbar in demselben Ringkomplex abgebaut werden können (Abb. 4). Möglicherweise liegt ein Grund für die Evolution dieses modifizierten Systems darin, dass FtsH, das für den Abbau von Membranproteinen zuständig ist, in die bakterielle Innenmembran integriert und somit räumlich fixiert ist [6]. Auf der einen Seite der Membran, im Periplasma, ragt die N-Domäne heraus, während ATPase- und Proteasedomänen auf der anderen Seite, im Cytoplasma, liegen, miteinander verbunden durch die sechs Transmembranbereiche des hexameren Komplexes.

Im Gegensatz zu löslichen Proteinen müssen membranständige Proteine bei der Entfaltung noch aus der Lipidschicht herausgelöst werden, was einen anderen Mechanismus der AAA ATPase erforderlich machen könnte. Dies wäre mit dem Transfer an separate externe Proteasen unter Umständen inkompatibel oder würde den Prozess ineffizient machen. Während die Strukturen der cytoplasmatischen ATPase- und Proteasedomänen von FtsH bereits bekannt sind, wurde kürzlich die Struktur der periplasmatischen N-Domäne bestimmt und, in Kombination mit computergestützter molekularer Modellierung, ein Modell des gesamten Proteins entwickelt, wie es vermutlich in der bakteriellen Innenmembran sitzt. Dieses Modell erlaubt nun die Planung biochemischer Experimente, um dem genauen Mechanismus der FtsH-Maschinerie auf die Spur zu kommen.
Einheit in der Vielfalt
FtsH ist nur eines von vielen Beispielen für den Variantenreichtum, der die Qualitätskontrolle von Proteinen ausmacht und gewährleistet. Während verschiedene Lebensformen im Laufe der Evolution jeweils für sie maßgeschneiderte Lösungen entwickelt haben, verwenden sie alle aber bemerkenswerterweise doch die gleichen Prinzipien aus ineinandergreifenden Regulierungs- und Kontrollebenen, in deren Zentrum ringförmige Entfaltungs- und Abbau-Nanomaschinen stehen. Die Erkennung, die Entfaltung und der Abbau von Proteinen werden so zu einem hochkomplexen Unternehmen, dessen Erforschung auch in Zukunft interessante Ergebnisse zu liefern verspricht.