Forschungsbericht 2016 - Max-Planck-Institut für Immunbiologie und Epigenetik
Steine im Mosaik: Welche Zellen bilden unsere Organe und woher kommen sie?
Die molekulare Erkennung einzelner Zelltypen
Der menschliche Körper ist ein komplexer Verbund verschiedener Organe und Gewebe, die ihrerseits aus einer sehr komplexen Mischung verschiedener Zellen zusammengesetzt sind. Zellen unterschiedlicher Funktion werden gemeinhin in verschiedene reife Zelltypen klassifiziert. Der Schlüssel zum Verständnis der Funktion eines Organs ist somit die Kenntnis aller auftretenden Zelltypen und ihres Zusammenwirkens. Krankheiten, die durch Fehlfunktionen bestimmter Organe hervorgerufen werden, lassen sich effektiver therapieren, wenn der zugrunde liegende Zelltyp identifiziert und gezielt behandelt werden kann.
Verschiedene Krankheiten, insbesondere Krebs, entstehen beispielsweise dadurch, dass Zellen ihre Entwicklung nicht bis zur Reife vollziehen und sich stattdessen in einem unreifen Stadium unkontrolliert vermehren. Daher ist es wichtig, nicht nur die reifen Zelltypen zu kennen, sondern auch alle Entwicklungsstadien, beginnend mit einer Stammzelle, die in manchen Fällen sämtliche Zelltypen eines Gewebes hervorbringen kann. Ist der verantwortliche Zelltyp einmal identifiziert, so lassen sich maßgeschneiderte Therapiemethoden entwickeln.

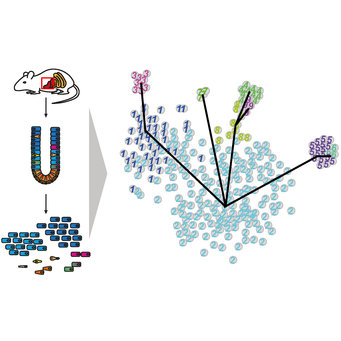
Abb. 1: Die Einzelzellsequenzierung einer komplexen Mischung verschiedener Zelltypen, beispielsweise einer Probe aus dem Darm, erlaubt die Identifizierung aller im Gewebe auftretenden Zelltypen. Hierzu werden bioinformatische Algorithmen verwendet, die anhand der Genexpressionsprofile in den einzelnen Zellen die Zelltypen selbstständig erlernen und alle Zellen klassifizieren. Darüber hinaus ist eine Ableitung der Abstammungsverhältnisse möglich.
Dieser offensichtliche Ansatz war jedoch bis vor kurzem nicht ohne weiteres umsetzbar, da die Entdeckung von Zelltypen nur eingeschränkt möglich war. In manchen Fällen lassen sich Zelltypen mikroskopisch voneinander unterscheiden, oder bekannte Proteine, die auf der Zelloberfläche sitzen, können dazu verwendet werden, Gruppen einander ähnlicher Zellen zu isolieren und weiter zu erforschen. Allerdings existieren nur verhältnismäßig wenige dieser Oberflächenmarker und oftmals sind sie nicht ausreichend, um ähnliche Zelltypen getrennt zu beobachten. Innerhalb der letzten fünf Jahre ist eine innovative molekularbiologische Methode entwickelt worden, um mit Hilfe der sogenannten Hochdurchsatzsequenzierung alle mRNA Moleküle in einzelnen Zellen zu erfassen, was zuvor nur für Proben mit Material, bestehend aus tausenden Zellen, möglich war [1]. Hierbei werden die RNA Moleküle von tausenden Genen gezählt und die jeweils relative Anzahl gibt unter anderem Aufschluss darüber, welche Proteine in der jeweiligen Zelle produziert werden. Da die Funktion vieler Proteine bekannt ist, hilft dies, auch die Funktion der gegebenen Zelle zu charakterisieren. Die derart generierten Daten sind sehr komplex, da RNAs von tausenden Genen in tausenden von Zellen gleichzeitig quantifiziert werden und sowohl biologische Variabilität zwischen Zellen als auch experimentelle Variabilität die Daten verrauschen. Mithilfe maßgeschneiderter statistischer Methoden die von Dominic Grün in den letzten Jahren entwickelt wurden [2, 3, 4], gelingt es aber inzwischen, verschiedene Zelltypen in noch unzureichend charakterisierten Organen und Geweben aufzulösen und deren Entwicklungswege, sogenannte Differenzierungstrajektorien, zu kartieren (Abb. 1).
Das Auffinden einzelner Immunzellen
Dank dieser neuen, erfolgreichen Methoden liegt der Forschungsschwerpunkt des Labors derzeit in der hochauflösenden Entschlüsselung der Differenzierungstrajektorien von Immunzellen. Verschiedene Immunzelltypen, wie beispielsweise B und T Zellen, sind zwar schon seit langem bekannt, aber die Differenzierung dieser Zelltypen, ausgehend von Stammzellen im Knochenmark, ist noch unzureichend erforscht. Insbesondere sind die seltenen Vorläuferstadien und reifen Subtypen noch nicht gut charakterisiert. Neue Arbeiten haben aber jetzt gezeigt, dass auch hier Einzelzellsequenzierung die Entdeckung seltener Zelltypen ermöglicht (Abb. 2, [3]). Die Arbeitsgruppe bedient sich hierzu der Maus als Modellsystem, da die Immunzellentwicklung der Maus der des Menschen sehr ähnelt und Gene in der Maus gezielt an- und ausgeschaltet werden können, um den Effekt auf die Zelldifferenzierung zu testen.

Die zukünftige Forschung soll, neben einem grundlegend besseren Verständnis normaler Entwicklungswege, auch gestörte Entwicklungswege bei Krankheiten des Immunsystems beleuchten. Hier liegt der Fokus auf bestimmten Krebsarten wie zum Beispiel der T-Zell akuten lymphatischen Leukämie. Ziel ist die Identifizierung der ursächlichen Zelltypen und nachfolgend der betroffenen, gestörten Mechanismen in diesen Zellen, deren genaues Verständnis die Entwicklung verbesserter, zielgerichteter Therapiemethoden verspricht. Für diese Form der Leukämie ist die Einzelzellanalyse von besonderer Relevanz, da sich gezeigt hat, dass Patienten nach anfänglich erfolgreicher, konventioneller Therapie mit großer Wahrscheinlichkeit einen Rückfall erleiden. Dies ist sehr wahrscheinlich auf seltene Krebsstammzellpopulationen zurückzuführen, die gegen Chemo- oder Bestrahlungstherapie resistent sind und zur erneuten Tumorbildung führen. Mit Hilfe der Einzelzellsequenzierung ließen sich genau diese seltenen Zellpopulationen identifizieren und charakterisieren, was die Entwicklung maßgeschneiderter Therapien zur Eliminierung dieser Zellen ermöglichen könnte.
Unter der molekularen Lupe: Organe des Menschen
Neben der Entschlüsselung von Differenzierungspfaden von Immunzellen wendet die Forschungsgruppe ihre hochentwickelte Methodik auch direkt auf humanes Material an, um die Zellkomposition bestimmter Organe im gesunden und kranken Zustand zu charakterisieren. In einer Kollaboration mit der Arbeitsgruppe von Thomas Baumert am Institut national de la santé et de la recherche médicale (INSERM), Straßburg, werden beispielsweise Leberproben untersucht, die entweder direkt von Tumoren befallen sind oder von Patienten entnommen wurden, die unter anderen Krebsarten leiden. Somit steht sowohl gesundes als auch tumorbefallenes Lebergewebe zur Verfügung, dass vergleichend untersucht wird. Damit kann erstmals das gesamte Spektrum der Leberzelltypen im Menschen hochauflösend beschrieben werden. Ein besonderes Ziel ist auch hier wieder die Identifizierung von Leberstammzellen, die potentiell zur Transplantation und Leberregeneration verwendet werden können. Diese Stammzellen ließen sich direkt mit den Tumorstammzellen vergleichen, was Aufschluss über die Tumorentwicklung gibt und neue Therapieansätze liefern könnte.
Ein weiteres Ziel der Wissenschaftlerinnen und Wissenschaftler ist die Entwicklung und Anwendung neuer Methoden, die die Quantifizierung von Genexpression in einzelnen Zellen mit räumlicher Auflösung direkt im Gewebe ermöglichen. Hierzu sollen insbesondere mikroskopische Methoden verwendet werden, nachdem einzelne RNA Moleküle in Zellen mit Hilfe von Farbstoffen sichtbar gemacht wurden. Damit soll erforscht werden, welche unterschiedlichen Zelltypen direkt miteinander wechselwirken und sich somit vielleicht sogar gegenseitig regulieren. Auf der Basis solcher Daten könnte das Funktionsnetzwerk der im Gewebe gemeinsam auftretenden Zelltypen erkannt werden. So ist beispielsweise schon bekannt, dass die Zelldifferenzierung im Allgemeinen von der Wechselwirkung der Stammzelle mit angrenzenden Gewebezellen, den sogenannten Nischen, abhängt. Über diesen Weg erhält die Stammzelle unter anderem das Signal, ob sie sich teilen soll oder nicht.
Ein weiterer Schwerpunkt der Forschung wird auch die Entwicklung von verbesserten, Computer-gestützten Algorithmen zur Verarbeitung der gewonnenen Einzelzelldaten sein. Hier gibt es im Bereich der Einzelzellbiologie weiterhin bestehenden Bedarf und es ist bereits absehbar, dass mit fortschreitender Entwicklung der Technologien sich auch die bioinformatischen Methoden mit gleichem Tempo verbessern werden müssen.
Von ihrer Arbeit erhoffen sich die Forscher ein grundlegend besseres Verständnis der Entwicklung und Wechselwirkung jener Vielzahl verschiedener Zelltypen, die das Funktionieren von Organen ermöglichen und, im Falle von genetischen oder epigenetischen Veränderungen oder Störungen, der Ausgangspunkt von Krankheiten sein können.