Forschungsbericht 2020 - Max-Planck-Institut für molekulare Physiologie
Krebszellen aushungern
Einleitung
Süßes macht viele Menschen glücklich, und viele Menschen geben zu, geradezu süchtig nach Zucker zu sein. Bei Krebszellen geht es sogar noch darüber hinaus: Viele Krebszellen können sich ohne Zucker nicht vermehren. Zucker in Form von Glukose erfüllt vielfältige Funktionen in der Zelle: Er dient als Energiequelle und liefert Bausteine für Biomoleküle, die für Zellteilung und -wachstum nötig sind.
Viele Krebszellen teilen sich sehr schnell und brauchen daher besonders viel Glukose. Im Normalfall wird diese in Anwesenheit von Sauerstoff hocheffizient und mit maximaler Energieausbeute verwertet. Herrscht jedoch Sauerstoffmangel, kann aus der Glukose nur ca. ein Sechstel der Energie gewonnen werden. Obwohl es in Krebszellen nicht immer an Sauerstoff mangelt, bevorzugen sie den ineffizienteren Verwertungsweg, denn er liefert die für das rasante Wachstum benötigte Energie und Bausteine um ein Vielfaches schneller als der herkömmliche. Um jedoch die ineffiziente Verwertung auszugleichen, benötigt eine Tumorzelle etwa die 10-fache Zuckermenge. Dieses Phänomen wurde vom Max-Planck-Wissenschaftler Otto Warburg bereits vor fast 100 Jahren beschrieben. Seine Entdeckung schuf die Grundlage für moderne bildgebende Verfahren in der Krebsdiagnostik, wie die Positronen-Emissions-Tomographie (PET). Sie macht sichtbar, wo im Körper vermehrt Zucker aufgenommen wird. So können die Lage und das Stadium des Tumors bestimmt werden.
Doch wie gelangt der Zucker in die Zellen? Glukose ist gut wasserlöslich und kann daher problemlos über das Blut zu den Zellen transportiert werden. Für die Aufnahme in die Zellen sorgen dann verschiedene Glukosetransporter (GLUT). Krebszellen weisen eine außergewöhnlich hohe Menge des Transporters GLUT-1 auf, was eine hohe Zuckerversorgung gewährleistet.
Die Natur als Vorbild
Wir wollen uns die Zuckersucht der Krebszellen zunutze machen, um sie zu bekämpfen. Wie bei der Suche nach der Nadel im Heuhaufen haben wir dafür eine Bibliothek mit über 150.000 chemischen Substanzen nach Wirkstoffen durchsucht, die den Glukosetransport in Zellen unterbinden. Dabei stießen wir auf drei Kandidaten, die sowohl den Transporter GLUT-1 als auch GLUT-3 blockieren. Zwei dieser Kandidaten stammen von Naturstoffen ab. Diese von der Natur entwickelten Substanzen dienen zahlreichen Arten beispielsweise zur Abwehr oder dazu, Partner anzulocken. Viele Naturstoffe haben sich auch als Medikamente für den Menschen erwiesen, wie beispielsweise das Opiat Morphin aus dem Schlafmohn oder die Penicillin-Antibiotika aus Pilzen. So dient die Natur der Arzneimittelforschung schon lange als Inspiration für die Entwicklung neuer Wirkstoffe. Heutzutage ist die Forschung in der Lage, noch einen Schritt weiterzugehen: wir können naturstoffähnliche Substanzen entwickeln, die in der Natur so nicht vorkommen. Indem wir zunächst die Grundbausteine aller bekannten Naturstoffe analysierten und sie dann auf eine neue Weise miteinander kombinierten, stellten wir Pseudo-Naturstoffe her, die den Glukosetransport unterbinden können.
Wachstumshemmende Wirkung auch im Zellverband
In Experimenten mit Zellkulturen zeigten unsere Substanzen dann tatsächlich den erwünschten Effekt: der durch den Wirkstoff (GLUT-Inhibitor) hervorgerufene Glukoseentzug verlangsamte das Wachstum von Krebszellen - schlussendlich starben diese. Dabei stellten wir fest, dass zwar verschiedenartige Krebszellen angegriffen wurden, gesunde Zellen aber verschont blieben.
Im Vergleich zur zweidimensionalen Zellkultur ist ein Tumor ein dreidimensionaler Zellverband, in dem die äußeren Zellen einen besseren Zugang zu Nährstoffen haben als die Zellen im Inneren. Um das Geschehen im Tumor möglichst realistisch darzustellen, haben wir den GLUT-Inhibitor auch in 3D-Zellgebilden, sogenannten
Sphäroiden, erforscht. Erstaunlicherweise führte der Wirkstoff auch hier zu einer Verlangsamung des Wachstums. Übereinstimmend mit Ergebnissen aus der Krebsforschung, die zeigten, dass die Verwertung von Glukose vor allem im Zentrum des Tumors gebraucht wird, starben vor allem die Zellen im Inneren der Sphäroide.
Kein Schlupfloch für Krebszellen
Doch leider lassen sich Tumore nicht immer so leicht austricksen. Nicht selten entwickeln sich in einer Therapie Wirkstoffresistenzen, oder die Krebszellen finden ein Schlupfloch. Denn für das Aufrechterhalten lebenswichtiger Vorgänge haben Zellen ausgeklügelte Mechanismen entwickelt, die Störungen umgehen können. Bei Glukosemangel können z.B. auch andere Nährstoffe, wie das Glutamin, verwertet werden. Glutamin ist als natürliche Aminosäure nicht nur einer der 21 Bausteine, aus denen Proteine zusammengesetzt sind, sondern auch ein wichtiger Schlüsselmetabolit. Daher haben wir Krebszellen mit einer Kombination aus unserem GLUT-Inhibitor und einem Inhibitor der Glutaminverwertung behandelt, was tatsächlich einen verstärkten wachstumshemmenden Effekt hatte.

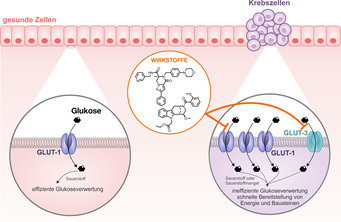
Abb. 1: Gesunde Zellen (rot) verwerten Glukose in Anwesenheit von Sauerstoff. Dieser Prozess ist zwar sehr effizient, aber langsam. Krebszellen (lila) wachsen besonders schnell. Sie verstoffwechseln den Zucker ohne Sauerstoff. Diese
Verwertung ist deutlich ineffizienter, allerdings umso schneller (sogenannter Warburg-Effekt).
Die ineffiziente Verwertung wird durch eine massiv erhöhte Zuckeraufnahme ausgeglichen. Hierfür produzieren Krebszellen besonders viele Glukosetransporter (GLUTs), vor allem GLUT-1. Unsere GLUT-Inhibitoren blockieren in Zellkultur-Experimenten die Zuckertransporter und hemmen somit die Zuckeraufnahme. Dadurch hungern die Krebszellen aus und sterben.
Eine weitere Ausweich-Option für die Tumorzellen bei Glukosemangel bietet die erhöhte Produktion des Glukosetransporters GLUT-3. Da unser GLUT-Inhibitor neben GLUT-1 ebenfalls GLUT-3 blockiert, wird auch dieser Schutzmechanismus der Krebszellen umgangen.
Nach wie vor zählt Krebs zu den häufigsten Todesursachen weltweit. Zahlreiche Forschungsgruppen arbeiten intensiv an Ansatzpunkten für neue Behandlungsmöglichkeiten. Die Krebsforschung hat viele neue Erkenntnisse gewonnen und innovative Strategien aus der Grundlagenforschung in die klinische Praxis überführt. So konnten die Überlebenschancen von Krebspatienten in den letzten 50 Jahren fast verdoppelt werden. Zurzeit werden unsere GLUT-Inhibitoren im Lead Discovery Center in Dortmund, gegründet von der Technologietransfer-Organisation MaxPlanck Innovation, zu sogenannten Leitstrukturen weiterentwickelt – ein erster Schritt auf dem langen Weg zum Medikament.