Forschungsbericht 2022 - Max-Planck-Institut für Psychiatrie
CRH-abhängige neuronale Netzwerke modulieren die Stressreaktion
CRH-dependent neural circuits modulate the stress response
Depressionen und Angststörungen gehören weltweit zu den häufigsten Erkrankungen der Psyche. Für ihre Entstehung spielt die Wechselwirkung zwischen individueller Veranlagung und Umweltfaktoren eine ursächliche Rolle. Die Anfälligkeit gegenüber diesen Erkrankungen kann bereits durch frühkindliche Stresserfahrungen geprägt und im späteren Leben durch chronischen Stress sowie eine fehlregulierte Stressreaktion beeinflusst werden.
Das Corticotropin-Releasing Hormon (CRH) reguliert die Stressreaktion
Das Neuropeptid Corticotropin-Releasing-Hormon (CRH) ist ein Botenstoff der sogenannten Stressachse, der Hypothalamus-Hypophysen-Nebennierenrinden (HHN)–Achse. Durch Aktivierung einer Hormonkaskade, die in der Freisetzung des Stresshormons Cortisol (bei Nagern: Corticosteron) mündet, spielt es eine zentrale Rolle in der physiologischen Stressreaktion [1]. Störungen der Aktivität und Regulation der Stressachse sowie Veränderungen auf der Ebene des CRH und seiner Rezeptoren wurden in Patienten mit einer Depression wiederholt nachgewiesen [2]. Während die CRH-abhängige Kontrolle der neuroendokrinen Stressreaktion inzwischen weitgehend verstanden ist, beginnen wir gerade erst, die Komplexität der CRH-abhängigen neuronalen Schaltkreise außerhalb des Hypothalamus zu verstehen.
Unser Team am Max-Planck-Institut für Psychiatrie konnte die grundlegende Bedeutung des CRH-Systems für die Stressreaktion und die Ausprägung von Angstverhalten nachweisen. Basierend auf diesen Ergebnissen der Grundlagenforschung wurden CRH Rezeptor Typ 1 (CRHR1)-spezifische Hemmstoffe entwickelt und zur Behandlung stressbedingter psychischer Erkrankungen getestet. Die Tatsache, dass die Substanzen in den klinischen Studien nur begrenzt Wirksamkeit zeigten, deutet darauf hin, dass das CRH-System wesentlich komplexer ist als ursprünglich angenommen [1]; es umfasst neben den beiden Rezeptoren vier Bindungspartner, die spezifisch, jedoch mit unterschiedlicher Affinität, an diese binden. Inzwischen gibt es neue Erkenntnisse, die belegen, dass CRH sowohl positive als auch negative Auswirkungen von Stress verstärken kann, was unter anderem von der Lokalisation aktivierter Rezeptoren abhängt. Beispielsweise wirkt der CRHR1 in Neuronen des Vorderhirns, die Glutamat als Botenstoff verwenden, eher angstfördernd, während er in Neuronen des Mittelhirns, die Dopamin produzieren, eher angstlösend wirkt [3].
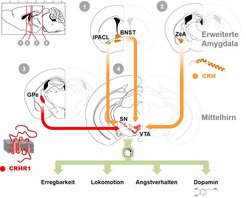
Die Gehirnbereiche der Amygdala (Mandelkern) und des Bett-Kerns der Stria terminalis (BNST, bed nucleus of the stria terminalis), die zusammenfasssend als erweiterte Amygdala bezeichnet werden, kontrollieren das Furcht- und Angstverhalten. Hier fanden wir CRH-Neurone, deren Axone sich bis ins Mittelhirn erstrecken. Diese CRH-Neurone stellen somit eine direkte Verbindung zwischen Regionen her, die einerseits von zentraler Bedeutung für die Kontrolle des Angstverhaltens, andererseits Bestandteil des durch Dopamin gesteuerten Belohnungs- und Motivationssystems des Gehirns sind (Abb. 1). Mit Hilfe genetischer Mausmodelle gelang es uns, die Mechanismen dieser angstlösenden neuronalen Schaltkreise weiter zu entschlüsseln. [4].
CRH-abhängige Netzwerke verbinden Regionen des Gehirns, die Emotion, Motivation und Bewegung kontrollieren
Darüber hinaus konnten wir in einer Unterregion der erweiterten Amygdala, der sogenannten IPACL-Region, eine bislang wenig beachtete Population von CRH-Neuronen identifizieren. Diese Neuronen sind ebenfalls direkt mit dem Mittelhirn verbunden, wo sie selektiv die Substantia nigra (SN) innervieren (Abb. 1). Die SN kontrolliert die Initiation von Bewegungen und deren Abläufe. Als wir diese CRH-Neuronen von Mäusen stimulierten, erkundeten die Mäuse in Folge verstärkt ihre Umgebung, was sich unter anderem in einer erhöhten motorischen Aktivität äußerte. Gleichzeitig waren die Tiere erregter und reaktionsbereiter. Ein Anstieg des Stresshormons Corticosteron und ein Stimulations-abhängiges Vermeidungsverhalten deutete darauf hin, dass die Tiere die Stimulation der CRH-Neuronen als unangenehm empfanden. Durch Experimente mit speziellen Hemmstoffen konnten wir nachweisen, dass dieses Verhalten direkt über eine Ausschüttung von CRH und die Aktivierung des CRHR1 erfolgt. Erstaunlicherweise steuert der CRH-Rezeptor im externen Globus pallidus (GPe) die motorische Aktivierung und das Vermeidungsverhalten. CRHR1-produzierende Neurone des externen GPe innervieren ihrerseits die SN (Abb. 1) und führen hier vermutlich zu deren Aktivierung [5].
Unsere Ergebnisse sind für das Verständnis der möglichen Rolle des CRH-Systems bei Depressionen, Angsterkrankungen, aber auch posttraumatischen Belastungsstörungen von Bedeutung. Veränderungen der Motivation, der Erregbarkeit und Reaktionsbereitschaft, aber auch ein gesteigertes Vermeidungsverhalten sind hier häufig zu beobachtende Symptome. Gleichzeitig zeigen die Ergebnisse, dass eine Hemmung von CRHR1 trotz der bisherigen negativen klinischen Studien ein sinnvoller therapeutischer Ansatz jenseits klassischer Antidepressiva sein könnte. Dafür sind jedoch zwei Voraussetzungen zu schaffen: zum einen, dass es im Rahmen klinischer Studien gelingt, geeignete Patienten zu identifizieren, d. h. solche, die Veränderungen im CRH-System aufweisen, und zum anderen, dass wir die Wirkung von CRHR1-Hemmstoffen besser verstehen, um diese Veränderungen gezielt beheben zu können.
