Forschungsbericht 2007
Chronobiologie: Das genetische Netzwerk der zirkadianen Uhr koordiniert die Wechselwirkung zwischen Lebewesen und Umwelt
The genetic network of the circadian clock coordinates the communication between the organism and its environment
Gene und Verhalten (Prof. Dr. Gregor Eichele)
MPI für biophysikalische Chemie, Göttingen
Hintergrund
Eine herausragende Eigenschaft aller Lebensformen ist ihre Fähigkeit, sich variablen Umweltbedingungen anzupassen. Pflanzen streben dem Licht entgegen; viele Tiere reagieren auf winterliche Kälte mit Winterschlaf. Ein gutes Beispiel dieses Wechselspiels zwischen Umwelt und Lebewesen ist die zirkadiane Uhr, mit der Organismen sich auf den 24-stündigen Tag/Nachtrhythmus der Erdumdrehung einregeln. Das ist sinnvoll, weil dadurch unter anderem Stoffwechsel und Verhalten den tageszeitlich variierenden Anforderungen angepasst werden können. Zum Beispiel macht es Sinn, dass Pflanzen tagsüber, aber nicht nachts, die Maschinerie zur Photosynthese in Betrieb halten. Wir Menschen regenerieren unseren Körper in der Ruhephase der Nacht. Hingegen ist es nicht notwendig, dass zu dieser Zeit die kognitiven Funktionen unseres Gehirns auf Höchstleistung laufen.
Der Begriff „zirkadian“ leitet sich vom lateinischen circa (ungefähr) und dies (Tag) ab und hebt hervor, dass diese innere Uhr nur näherungsweise einen 24-Stunden-Takt hat. Welchen Zweck hat diese zirkadiane Uhr überhaupt, könnte man sich fragen. Würde der tägliche Wechsel von Tag und Nacht – und damit Licht und Dunkel – nicht ausreichen, die oben genannte 24-Stunden-Rhythmik zu regulieren? Dass das allein nicht ausreicht, wird klar, wenn man sich den Licht/Dunkel-„Rhythmus“ unseres modernen Lebens anschaut. Wenn unsere physiologischen Rhythmen allein eine Reaktion auf die An- oder Abwesenheit von Licht oder Dunkelheit darstellen würden, hätte jeder verlängerte Abend, z.B. am Wochenende, mit all seinen künstlichen Lichtquellen desaströse Auswirkungen auf unseren Schlaf/Wachrhythmus und auf den gesamten Stoffwechsel. Stattdessen signalisiert unsere innere Uhr uns, dass es sich hierbei um fehlplatzierte äußere Zeitsignale handelt, und hält so den Organismus zeitlich stabil.
Diese Trägheit der zirkadianen Uhr kann sich manchmal auch negativ auswirken, beispielsweise beim Jetlag. Auf Fernreisen in Ost-West-Richtung oder umgekehrt erfährt man nach der Ankunft eine unangenehme Überraschung: Der Tag/Nacht-Zyklus der neuen Umgebung und der Rhythmus des eigenen Körpers sind plötzlich voneinander entkoppelt. Man fühlt sich matt und angespannt, der Schlafrhythmus und die Verdauung sind gestört, weil in der neuen Umgebung externe und interne Zeit nicht mehr in Übereinstimmung sind. Innerhalb einiger Tage gleicht sich die innere Uhr dann an die neue Zeitzone an, und die Symptome verschwinden. Diese einfachen Selbstbeobachtungen lehren uns zweierlei: Einerseits zeigen sie, dass der Wechsel von Hell und Dunkel alleine den Rhythmus des Körpers nicht unmittelbar kontrolliert. Andererseits wird klar, dass ein Nachstellen der inneren Uhr möglich ist, sich aber über einige Tage hinziehen kann. Die Forschung auf dem Gebiet der zirkadianen Rhythmik will erklären, woraus die zirkadiane Uhr besteht und wie sie sich den Bedingungen der Umwelt anpasst, also wie z.B. der Jetlag überwunden werden kann.
Praktisch alle Organe bzw. Zellen in unserem Körper sind mit einem zirkadianen Uhrwerk ausgestattet (siehe unten). Besonders wichtig ist aber die Uhr im so genannten Nucleus suprachiasmaticus (SCN), gelegen an der Basis des Hypothalamus des Gehirns. Der SCN ist eine Ansammlung von zirka 20.000 eng miteinander verknüpften Nervenzellen und ist mit diversen anderen Gehinregionen verschaltet. Entfernt man den SCN mittels Mikrochirurgie, z.B. bei Hamstern, so verlieren diese ihren Tagesrhythmus. Dies lässt sich leicht zeigen, indem man den Tieren ein Laufrad in den Käfig gibt, dessen Umdrehungen – und damit die Aktivität des Hamsters – man mittels Sensoren registriert. Normale Hamster treiben Radsport nur nachts, solche ohne SCN zeigen Bewegungsaktivität in unregelmäßigen Abständen, sowohl nachts wie auch am Tag.
Die molekulare zirkadiane Uhr
Das zirkadiane Uhrwerk in den Nervenzellen des SCN besteht aus einem im Prinzip einfachen Netz von Genen und Proteinen, die im Laufe der letzten Jahrzehnte entdeckt wurden und deren Zusammenspiel man zu verstehen beginnt.
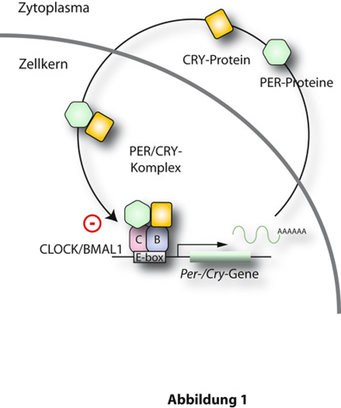
Zwei Faktoren (BMAL1 und CLOCK, siehe Abb. 1) sind Aktivatorproteine, welche jeden Morgen die Cryptochrome- (Cry) und Period (Per)-Gene anschalten (Gennamen werden hier kursiv gedruckt, Proteine sind in Großbuchstaben wiedergegeben). Gemäß genereller Mechanismen des Ablesens genetischer Information werden im Kern der SCN-Nervenzellen zuerst die entsprechenden Boten-RNAs (mRNAs) hergestellt, die dann im Zellplasma in die CRY- und PER-Proteine übersetzt werden. Diese bilden Komplexe und wandern im Verlaufe des Nachmittages und Abends dann wieder zurück in den Zellkern, wo sie die Funktion von BMAL1 und CLOCK blockieren. Dadurch wird die Produktion von Cry- und Per-mRNA abgeschaltet. Im Laufe der Nacht fällt dadurch die Menge an CRY und PER in der Zelle wieder so weit ab, dass die Blockade von CLOCK und BMAL1 zu Ende geht und (gegen Morgen) eine neue Runde der Cry- und Per-Aktivierung beginnt. Dieses Wechselspiel von Genaktivierung und -inhibition definiert den ~24-Stunden-Takt der zirkadianen Uhr. Eine wichtige Lektion aus der molekularen Analyse der Uhr ist, dass sie aus einem fest verdrahteten Räderwerk besteht. Wenn man an diesen Rädern herumbastelt, z.B. das Per-Gen mittels genetischer Manipulation (d.h. homologe Rekombination) entfernt, so bricht die zirkadiane Uhr weitgehend auseinander [1]. Eine derartig behandelte Maus wird also nur sehr unregelmäßig im Laufrad rennen. Unter natürlichen Bedingungen hätte sie große Schwierigkeiten, sich an den Tagesrhythmus anzupassen und würde so leicht ein Opfer von (zumeist tagaktiven) Raubtieren werden.

Die vorübergehende Natur des Jetlags zeigt, dass die zirkadiane Uhr verstellbar ist. Dies geschieht vor allem mittels Licht. Im Laborexperiment wird diese Lichtsynchronisation wie folgt nachgestellt: Man setzt eine Maus in einen mit Laufrad ausgestatteten Käfig in permanenter Dunkelheit. Unter diesen „zeitfreien“ Bedingungen richtet sich die Laufradaktivität des Tiers allein nach dessen innerer Uhr. Diese hat bei Mäusen in konstanter Dunkelheit eine Periodenlänge von 23,5 Stunden, d.h. die Maus beginnt jeden Tag eine halbe Stunde früher zu laufen. Dieser Rhythmus ist minutengenau und bleibt über Monate hinweg konstant. Gibt man dieser Maus nun einen 15-minütigen Lichtpuls zu Beginn ihrer Aktivitätsphase, beobachtet man am darauffolgenden Tag, dass sie das Laufrad etwa eine Stunde später als erwartet betritt. In den darauffolgenden Tagen zeigt sie wieder den ursprünglichen 23,5-Stunden-Rhythmus. Das bedeutet, die Laufgeschwindigkeit der zirkadianen Uhr wurde durch den Lichtpuls vorübergehend verzögert. Im SCN bewirkt der Lichtpuls zwei Prozesse (Abb. 2). Einerseits induziert er eine zusätzliche Produktion von Per-mRNA. Das geschieht durch die Aktivierung des CREB-Proteins, das daraufhin an die Kontrollregion des Per-Gens bindet und dieses aktiviert [2]. Das neu gebildete PER-Protein verzögert dann die Uhr über eine verlängerte Inhibition von CLOCK/BMAL1 (siehe oben). Zum anderen bewirkt der Lichtpuls ein Binden von PER an ein Regulatorprotein (die alpha-Form der Proteinkinase C). Dadurch wird vermutlich die Rückwanderung des PER/CRY-Komplexes in den Zellkern verzögert, was ebenfalls zu einer verspäteten Hemmung von CLOCK/BMAL1 – und damit zu einer Verlangsamung der Uhr – führt [3].

Die Regulation des in Abbildung 1 schematisierten molekularen Netzwerks der inneren Uhr ist in Wirklichkeit weitaus komplexer, und es existieren eine Reihe weiterer potenzieller Uhrengene, die hier noch nicht dargestellt sind. Ein Beispiel dafür ist Timeless (Tim), das in der zirkadianen Uhr der Fruchtfliege Drosophila melanogaster eine zentrale Rolle spielt. dTIM („d“ für Drosophila) ist ein wichtiger Interaktionspartner von dPER. Ähnlich der CRY-Proteine in Säugern bindet dTIM an dPER und wandert mit ihm zusammen zurück in den Zellkern, wo beide die Aktivierung ihrer eigenen Gene durch dCLOCK und dCYCLE, die Fliegenhomologen von CLOCK und BMAL1, hemmen. Ein Verlust von dTim führt zu einem Stillstand der Fliegenuhr. Leider sind Mäuse, bei denen das Tim-Gen fehlt, nicht lebensfähig, was eine Untersuchung der Uhrenfunktion natürlich ausschließt. Ein laufendes Projekt in der Abteilung Gene und Verhalten am MPI für biophysikalische Chemie beinhaltet deshalb die konditionelle Entfernung des Tim-Gens in der Maus. In der Praxis wird dabei vor und nach dem Tim-Gen jeweils eine sog. loxP-Sequenz eingefügt. Mäuse mit diesen zusätzlichen Sequenzen sind gesund und munter, bis man sie mit anderen Mäusen kreuzt, die die sog. CRE-Rekombinase in ihren Zellen produzieren. Diese Rekombinase wirkt wie eine molekulare Schere, die Gensequenzen zwischen zwei loxP-Stellen ausschneidet und das Chromosom über die loxP-Stellen hinterher wieder miteinander verbindet. In unserem Falle wird so das loxP-umrahmte Tim-Gen deletiert. Wenn nun für die Verpaarung Mäuse verwendet werden, die CRE-Rekombinase nur in bestimmten Geweben – z.B. dem SCN – produzieren, oder solche, bei denen das CRE-Enzym erst durch die Injektion einer Substanz aktiviert wird, lassen sich negative – oder sogar fatale (s.o.) – Effekte einer Tim-Deletion außerhalb des zirkadianen Systems oder während der Embryonalentwicklung umgehen. So wird es möglich, Genfunktionen unter Gewebe- und zeitlich hochspezifischen Bedingungen zu untersuchen. Derart „manipulierte“ Tim-defiziente Mäuse werden im Laufradexperiment und auch mittels molekulargenetischer Messmethoden auf die Funktion ihrer zirkadianen Uhr hin erforscht. Zusammen offenbart sich so das wahre Gesicht von Timeless – in der Maus und vermutlich auch im Menschen, der ebenfalls ein Timeless-Gen besitzt.
Zirkadiane Uhren überall
Das Timeless-Experiment wird neue Erkenntnisse zur Evolution von Uhrenmechanismen bringen. Die nachfolgend beschriebenen Studien heben die Universalität zirkadianer Rhythmik sowie das Zusammenspiel verschiedener zirkadianer Uhren innerhalb eines komplexen Organismus wie dem der Maus hervor.
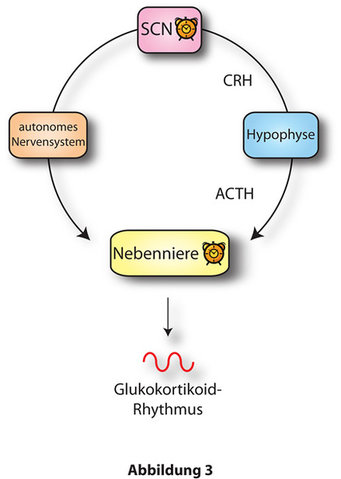
Uhrenproteine finden sich nicht nur in der Zentraluhr des SCN. Tatsächlich enthalten (fast) alle Zellen unseres Körpers die genetische Ausstattung zur Bildung einer funktionellen zirkadianen Uhr. Genomweite Expressionsanalysen haben ergeben, dass Uhrengene tatsächlich in den meisten Geweben – und mit ihnen hunderte von weiteren, sog. uhrenkontrollierten Genen – wie im SCN im 24-Stunden-Rhythmus aktiviert und deaktiviert werden. Diese Uhren nennt man „periphere Oszillatoren“. Das Zusammenspiel von SCN und peripheren Uhren reguliert weite Teile unserer Physiologie und unseres Metabolismus. Ein Beispiel dafür ist die Nebenniere. Die Nebenniere sitzt oberhalb der Niere und ist eines der wichtigsten hormonproduzierenden Organe unseres Körpers. Sie produziert drei Klassen von Hormonen, die Kortikoide (z.B. Kortisol und Aldosteron), die Katecholamine wie Adrenalin und Noradrenalin, sowie geringe Mengen an Sexualsteroiden wie Östrogen und Testosteron. Besonders die Produktion der Kortikoide zeigt dabei einen starken zirkadianen Rhythmus. Gesteuert wird der Kortikoidrhythmus vom Hypothalamus – und damit ultimativ vom SCN – über die sog. Hypothalamus-Hypophysen-Nebennieren-Achse (englisch: hypothalamus pituitary adrenal (hpa) axis). Von der Hypophyse wird dabei das Hormon ACTH sekretiert, welches in der Nebenniere die Produktion von Glukokortikoiden (Kortisol im Menschen, Kortikosteron in der Maus) stimuliert.

Untersuchungen der Gruppe um Eichele und Oster haben gezeigt, dass die Nebenniere ebenfalls über eine zirkadiane Uhr verfügt [4]. Diese Uhr wird über das autonome Nervensystem mit dem SCN – und damit ultimativ mit dem Tag/Nachtzyklus – synchronisiert. Doch wozu braucht es eine Nebennierenuhr, wenn der Kortikoid-Tagesrhythmus doch schon vom SCN über die hpa axis vorgegeben wird? Die Antwort wird klar, wenn man Nebennieren von normalen Tieren und von Mausmutanten mit defekter zirkadianer Uhr in Kultur nimmt. Kultivierte Wildtyp-Nebennieren zeigen einen zirkadianen Rhythmus in ihrer Sensitivität auf Stimulation mit ACTH, während die Reaktion von mutanten Geweben immer gleich ausfällt. Was bedeutet das aber im lebenden Tier? Diese Frage konnte mithilfe von Transplantationsexperimenten geklärt werden. Wird eine mutante Nebenniere in ein Wildtyp-Tier verpflanzt, wird der Kortikoidrhythmus um ca. 50% gedämpft. Das bedeutet, dass für eine normale, rhythmische Kortikoid-Ausschüttung SCN- und Nebennierenuhr – und damit ACTH-Sekretion und Nebennierensensitivität – synchron miteinander laufen müssen. Fällt einer von beiden Rhythmen aus, wird der Kortikoidrhythmus gedämpft. Wenn Zentral- und periphere Uhr ausfallen, gibt es auch keinen Hormonrhythmus mehr (Abb. 3). Die Nebennierenuhr ist deshalb ein gutes Beispiel für das Zusammenspiel zentraler und peripherer zirkadianer Uhren in der Regulation physiologischer Funktionen.
Aktuelle Projekte beschäftigen sich mit der Funktionalität eines anderen wichtigen Oszillators, der Leber. Mithilfe neuer gentherapeutischer Ansätze soll die Frage beantwortet werden, inwiefern die Leberuhr eine Rolle spielt in der Regulation des Fettstoffwechsels und bei der Entwicklung von Zivilisationskrankheiten wie dem metabolischen Syndrom.