Forschungsbericht 2011 - Max-Planck-Institut für biologische Intelligenz (Standort Martinsried)
Die Evolution des Geruchssinns
Es ist allgemein bekannt, dass der Geruchssinn bei vielen Säugetieren, wie etwa Hunden, sehr gut ausgeprägt ist und eine wichtige Rolle spielt. Über die ‚Nasen‘ von Insekten hingegen wissen die meisten nur wenig. Die Arbeitsgruppe von Ilona Grunwald-Kadow am Max-Planck-Institut für Neurobiologie erforscht den Geruchssinn und die Verarbeitung von Gerüchen im Gehirn von Insekten. Konkret wollen die Wissenschaftler verstehen, wie Gene den Aufbau eines Nervensystems kontrollieren, welches Gen ein bestimmtes Verhalten steuert. Die Gruppe hat untersucht, wie Gene – über ihre Bildung oder Nicht-Bildung – bestimmen könnten, wie sich ein Insekt nach Duftkontakt verhalten wird.
Warum Insekten? Eine ganze Reihe guter Gründe hat vor einigen Jahrzehnten besonders ein Insekt in den Blickpunkt von Naturwissenschaftlern in der ganzen Welt gerückt: die Fruchtfliege Drosophila melanogaster. Die etwa 2,5 mm große Fliege mit den knallroten Augen hat nicht nur ein sehr kompaktes Nervensystem, sondern auch eine Erbinformation, die der unsrigen sehr ähnlich ist. Mit anderen Worten heißt das, dass ein Gen mit hoher Wahrscheinlichkeit in Drosophila fundamental genau das Gleiche macht wie in der Maus, dem Hund oder dem Menschen. Anders als Maushaltung ist die Haltung von Fliegen im Labor denkbar einfach und kostengünstig. Anhand von Gentechnik in Fliegen haben Wissenschaftler Erstaunliches über die Funktion der menschlichen Gene gelernt. In den letzten Jahren ist die Fruchtfliege mehr und mehr auch in den Fokus der Neurobiologen gerückt. Intensive Verhaltensstudien zeigten, dass Fliegen und andere Insekten ein ausgeprägtes Seh- und Geruchssystem besitzen und sogar lernen können.
Riechen mit Antennen – die Nase der Insekten

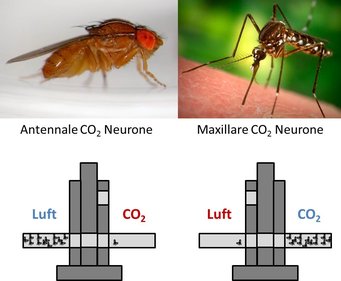
Ein weiterer Vorteil an der Arbeit mit Fliegen besteht für die „Kadow-Gruppe“ darin, dass der Geruchssinn von Insekten dem des Menschen sehr ähnlich ist. Betrachtet man eine Fliege von außen, überwiegen die deutlichen Unterschiede. Insekten und somit auch Drosophila riechen mit ihren Antennen oder einem weiteren Geruchsorgan, der sogenannten Maxille (Abb. 1). Und obwohl diese externen Geruchsorgane so unterschiedlich aussehen, sind die molekularen Vorgänge des Riechens vergleichbar. Riechzellen, auch Geruchsneurone genannt, produzieren Oberflächenproteine, die Duftrezeptoren, die bestimmte Duftstoffe binden und als Signal in die Riechzelle weiterleiten können. Um möglichst viele verschiedene Düfte wahrnehmen und unterscheiden zu können, bildet jede Riechzelle oder eine kleine Gruppe von Riechzellen eine eigene Version dieses Duftrezeptors. Um die Information über die Duftumgebung zu verarbeiten, senden Riechzellen Nerven in das Gehirn. Dort bilden sie mit anderen weiterverarbeitenden Neuronen eine Schaltstelle, auch Synapse genannt. Damit das Hirn die Duftinformation weiterverarbeiten kann, wird die Duftumgebung aus einem Mix an Duftstoffen in eine räumliche Karte umgewandelt. Mit anderen Worten: Vanilleduft aktiviert eine Gruppe von Neuronen im Gehirn, die räumlich von denen getrennt sind, die Schwefelduft erkennen. Dieser geniale Trick wird in einer Hirnstruktur verwirklicht, die beim Menschen olfaktorischer Bulbus und bei Insekten Antennallobus heißt (Abb. 1). Beide Strukturen bilden sogenannte Glomeruli, knotenartige Ansammlungen von Nervenenden-, die von einem duftabhängigen Code aktiviert werden. Sobald ein Duft oder ein Duftgemisch einen oder mehrere dieser Glomeruli aktiviert hat, werden die Signale durch weitere Neurone in einer Glomerulus-abhängigen Weise an die höheren Hirnzentren weitergegeben. In den höheren Hirnstrukturen werden dann weitere Informationen, wie z. B. visueller Input und Erinnerungen mitverarbeitet, um ein der Situation angemessenes Verhalten zu initiieren.
CO2 – anziehend oder abstoßend?

Natürlicherweise haben verschiedene Düfte eine unterschiedliche Bedeutung für ein bestimmtes Tier oder den Menschen. Manche Bedeutungen sind erlernt, andere sind rein instinktiv und angeboren. Zu den Düften, die ein starkes angeborenes Verhalten auslösen, gehört Kohlendioxid (CO2). Bei vielen Tieren und auch beim Menschen können hohe Konzentrationen an CO2 Fluchtverhalten oder sogar Panikattacken auslösen. Ein Grund für dieses Verhalten ist möglicherweise, dass hohe Konzentrationen von CO2 ein Indiz für eine niedrige Sauerstoffkonzentration sein können. Die Fliege Drosophila reagiert ähnlich und flüchtet schon vor relativ niedrigen Konzentrationen an CO2 (Abb. 2). Interessanterweise reagieren einige Insekten genau umgekehrt: Sie lieben CO2. Ein bekanntes und wichtiges Beispiel ist die blutsaugende Mücke (Abb. 2). Mücken nutzen CO2, um Menschen bzw. Tiere zu lokalisieren. Ein Mensch atmet ca. 4-5 Prozent CO2 mit jedem Atemzug aus. Mücken können schon ein Zehntel davon detektieren und daher über längere Distanzen die CO2-Quelle aufstöbern. Das heißt, dass bei zwei Insekten, die ungefähr 250 Millionen Jahre Evolution trennen, ein komplett entgegengesetztes Verhalten durch den gleichen Stimulus, nämlich CO2, ausgelöst wird.
Vom Gen zum Verhalten
Gene kontrollieren den Aufbau von Nervensystemen. Der Aufbau von Nervensystemen kontrolliert das Verhalten. Gene und ihre Produktionsmuster, wie auch Nervensysteme und Verhaltensweisen, unterliegen den Regeln der Evolution. Wie haben sich Gene, Genbildung und -funktionen verändert, um ein Nervensystem so zu verändern, dass es konträre Verhaltensweisen auslöst? Wie oben beschrieben aktivieren Düfte bestimmte Muster oder Glomeruli im Hirn. Je nach Aktivierungsmuster bekommen die höheren Hirnzentren einen unterschiedlichen Befehl. Mücken bewegen sich zu CO2 hin, Fliegen davon weg. Das kann in einfachen Labortests untersucht werden, wie z. B. dem T-maze (Abb. 2).
Parallel dazu findet man, dass CO2 in beiden Tieren sehr unterschiedliche Aktivierungsmuster im Antennallobus auslöst. Diese Aktivierungsmuster resultieren aus der unterschiedlichen Lokalisation der CO2 detektierenden Rezeptorneurone selbst und ihrer Projektionsmuster im Antennallobus. In der Fliege sitzen die CO2-Neurone ausschließlich auf der Antenne und schicken ihre Axone zu einem bestimmten einzelnen Glomerulus. In der Mücke wird ein komplett anderer Glomerulus von CO2-Neuronen angesteuert, die exklusiv auf den Maxillen zu finden sind. Da Düfte, die die maxillaren Rezeptorneurone aktivieren, typischerweise Futtergerüche sind, erscheint es fast logisch, dass bei Mücken CO2-Neurone auch dort zu finden sind. Gene, die die Struktur dieser beiden CO2-sensorischen Systeme bestimmen, steuern somit auch indirekt das Verhalten der Tiere.

Welche Gene sind verantwortlich und wie hat sich ihre Funktion im Laufe der Evolution verändert, um diese unterschiedlichen Nervensysteme hervorzubringen? Durch Nutzung der Fliege als genetischen Modellorganismus wurden mehrere wichtige Gene gefunden, die möglicherweise die Diversifizierung der CO2-Nervensysteme dieser beiden Insekten gesteuert haben [1, 2]. Eines dieser Gene ist eine sogenannte microRNA. MicroRNAs sind kürzlich entdeckte Moleküle, die ähnlich wie die DNA aufgebaut sind, aber Ribo- statt Desoxyribonukleinsäuren enthalten. Ganz anders als DNA oder herkömmliche, sogenannte messenger RNA, kodieren sie nicht für ein Protein, sondern agieren als Inhibitoren für die Produktion ganz spezifischer Zielproteine. Diese Inhibition ist räumlich und zeitlich sehr eng an die Proteinproduktion der Zelle gekoppelt und ist daher sehr nützlich, um schnell Proteinmengen zu reduzieren bzw. insgesamt eine Überproduktion eines bestimmten Proteins zu verhindern. Fliegen, denen diese microRNA, miR-279, fehlt, entwickeln ein CO2-sensorisches System, das dem der Mücken sehr ähnlich ist (Abb. 3).
Wie in Mücken besitzen diese Fliegen CO2-Neurone auf ihren Maxillen. Diese CO2-Neurone innervieren die gleichen Glomeruli, die auch in der Mücke von CO2-Neuronen innerviert werden. Durch weitere Untersuchungen konnte die Gruppe zeigen, dass miR-279 in der normalen Fliege Teil eines Signalnetzwerks ist, das die Produktion von zwei bestimmten Proteinen unterdrückt. Nicht unterdrückt, haben diese Proteine die Eigenschaft, die Entwicklung von maxillaren CO2-Neuronen hervorzurufen und auch deren Verbindungen zum Antennallobus zu steuern. Die gefundenen genetischen Faktoren aus der Fliege sind alle auch in der Mücke vorhanden. Allerdings scheint ihre Interaktion im Vergleich zur Fliege möglicherweise verändert. Diese evolutionäre Veränderung könnte zur Folge gehabt haben, dass Mücken CO2-Neurone auf ihren Maxillen besitzen, deren Aktivierung eine CO2-Anziehung hervorruft.
Mücken, die kein CO2 mehr mögen
Mücken, die kein CO2 mehr detektieren können – das wäre das ideale Ergebnis der Studien des Teams um Ilona Grunwald-Kadow. Denn solche Mücken hätten Probleme, Menschen oder Tiere aufzuspüren. Langfristig könnten diese Ergebnisse also dazu beitragen, krankheitsübertragende Moskitos vom Stechen abzuhalten. Leider liegen noch viele Schritte zwischen den vorgestellten Ergebnissen und einer „CO2-blinden“ Mücke. Zunächst soll gezeigt werden, dass die gleichen Faktoren, wie auch in Drosophila, die CO2-Neurone auf Maxillen von Mücken induzieren. Derzeit ist die Mücke bei weitem kein so praktischer genetischer Modellorganismus wie Drosophila. Die Wegnahme oder Veränderung eines Gens oder Proteins oder einer microRNA in der Mücke gestalten sich als recht schwierig. In Zusammenarbeit mit der Gruppe von Elena Levashina am Max-Planck-Institut für Infektionsbiologie in Berlin und Eric Marois an der Universität von Straßburg werden Methoden entwickelt, um CO2-Neurone mit genetischen Methoden sichtbar und manipulierbar zu machen. Eine spannende Frage ist, ob die microRNA miR-279 in der Mücke die Bildung von CO2-Neuronen ganz oder zumindest teilweise verhindern kann.