Forschungsbericht 2004
Neues Gesetz zur Auflösung in der Lichtmikroskopie ermöglicht Bilder in bisher unbekannter Schärfe
New law in light microscopy allows for unprecedented resolution
Seit dem 17. Jahrhundert war das Lichtmikroskop wie kaum ein anderes Instrument ein Schlüssel zur wissenschaftlichen Erkenntnis. Das gilt insbesondere für die Biologie, da die Beobachtung von lebenden Zellen auf nicht-invasive optische Verfahren wie die Lichtmikroskopie angewiesen ist. Doch die Verwendung von sichtbarem Licht unterliegt der Beugungsgrenze, die von Ernst Abbe entdeckt wurde, dessen Todestag sich im Jahr 2005 zum hundertsten Mal jährte. Sie besagt, dass sich mit Licht in der Bildebene (x,y) nur Objekte trennen lassen, die mindestens um den Abstand Δd = λ/(2n sin α) voneinander entfernt sind, weil der am Fokuspunkt entstehende Durchmesser des Lichtflecks (Spot) nicht kleiner als dieser Abstand Δd sein kann. Dabei bedeutet λ die Wellenlänge des Lichts, n der Brechungsindex der Probe und der halbe Öffnungswinkel des fokussierten Lichtkegels. Da Wellenlänge und Öffnungswinkel auf λ=400-700 nm bzw. auf α z) beträgt die Auflösung sogar nur λ. Zwar konnte die z-Auflösung durch die kohärente Verwendung zweier gegenüberliegender Objektive im 4Pi-Mikroskop deutlich erhöht werden (siehe MPG-Jahrbuch 1999), jedoch ist auch das 4Pi-Mikroskop der Beugungsgrenze unterworfen, und das gilt auch für die Fokalebene.
Abbes Formel, etabliertes Lehrbuchwissen und in einer Jenaer Gedenkstätte in Stein gemeißelt, galt für mehr als ein Jahrhundert als praktisch unüberwindbar (Abb. 1). Nur ein neues physikalisches Konzept konnte eine radikale Auflösungserhöhung leisten. Die Erstellung solcher Konzepte, deren experimentelle Verifizierung und Umsetzung sind zentrale Forschungsaufgabe der Abteilung NanoBiophotonik am Göttinger MPI für biophysikalische Chemie. Ziel ist auch deren Nutzbarmachung für die biologische Grundlagenforschung und die Nanotechnologie.

Auflösung jenseits der Beugungsgrenze
Die Fluoreszenzmikroskopie spielt in den Lebenswissenschaften eine herausragende Rolle. Die Gründe dafür sind vielfach. Die charakteristische Wellenlänge (Farbe) der Fluoreszenzemission eignet sich hervorragend, Zellbestandteile spezifisch zu markieren. So können beispielsweise Proteine bei vernachlässigbarem Untergrund gezielt in der Zelle erfasst werden. Hinzu kommt, dass die Bedeutung der Fluoreszenzmikroskopie durch Fortschritte auf dem Gebiet der Fluoreszenzmarker selbst enorm beschleunigt wurde. So ist es durch genetische Modifikation möglich, die Zelle dazu zu bewegen, ihren eigenen Fluoreszenzmarker in der Gestalt eines grün, gelb oder rot fluoreszierenden Proteins zu liefern und zwar so, dass das Markerprotein schon bei der Entstehung genau mit dem Zielprotein verknüpft ist. Die Zelle bleibt dabei fast immer physiologisch intakt. Es ist daher nicht überraschend, dass circa 80 % aller Mikroskopie-Untersuchungen in der Biologie auf die Fluoreszenzmikroskopie fallen.
Glücklicherweise eröffnet aber gerade die Interaktion zwischen Licht und Fluoreszenzmarker eine Reihe von Ansätzen, die Beugungsgrenze radikal zu überwinden. In der Fluoreszenzmikroskopie werden die Marker in einen Zustand angeregt, der bei der Rückkehr in den Grundzustand Fluoreszenzlicht emittiert. Weil das anregende Licht der Beugung unterliegt, kann der räumliche Fleck fluoreszierender Moleküle (Spot) gemäß Abbe aber nicht feiner als Δd = 200 nm werden. Es sei denn, man verwendet einen physikalischen Trick.
Dieser Trick besteht nun darin, dass die Forscher den Fluoreszenzmarker vorübergehend und lokal in einen nicht-fluoreszierenden Zustand überführen, und zwar so, dass die Fluoreszenz am Ende aus einem räumlichen Bereich stammt, der enger als der Lichtfleck des Anregungslichts ist. Auflösungen jenseits der Beugungsgrenze erreicht man einfach dadurch, dass man die Probe mit diesem schärferen Spot abrastert und das Bild Punkt für Punkt erstellt, indem man die jeweils registrierte Fluoreszenzintensität mittels eines Rechners aneinanderreiht.
Dieses allgemeine Konzept ist in verschiedenen Realisierungen denkbar. Zum vorübergehenden Versetzen in einen nicht-fluoreszierenden Zustand eignen sich optisch sättigbare Übergänge, die entscheidend an der Fluoreszenz beteiligt sind. Sie müssen reversibel sein, damit der Marker dabei nicht unwiederbringlich verändert wird und das entstehende Bild somit verfälscht. Bei diesem neuen Konzept, genannt RESOLFT (von engl. reversible saturable optical fluorescent transitions), sind für die Auflösung keine prinzipiellen Grenzen gesetzt; sie hängt nur von dem erreichbaren Sättigungsgrad ab. Im Grunde genommen sind damit molekulare Auflösungen möglich. Der erste Repräsentant des RESOLFT-Konzepts ist die STED-Mikroskopie (von engl.: stimulated emission depletion), die im Folgenden etwas detaillierter dargestellt wird.
STED-Mikroskopie
Mit Licht kann man nicht nur ein Molekül anregen, sondern auch ein angeregtes Molekül schlagartig abregen und zwar durch 'stimulierte Emission'. Bei diesem von Einstein vorhergesagten Prozess (Abb. 2 a) wird die Energie des ehemals angeregten Moleküls als ein weiteres Photon des stimulierenden Lichtstrahls mitgeführt. Dabei ist das neu entstandene Photon identisch mit den stimulierenden Photonen, die sich wiederum deutlich in Wellenlänge und Ausbreitungsrichtung von denjenigen des Fluoreszenzlichts unterscheiden. Damit lässt sich Fluoreszenzlicht sehr gut von dem stimulierten oder dem stimulierenden Licht trennen. Abgeregte Moleküle können sofort wieder angeregt und von neuem abgeregt werden; der Prozess ist reversibel.
Entscheidend für die Überwindung der Auflösungsgrenze ist aber nicht das Abregen an sich, sondern die Tatsache, dass das Abregen übersättigt wird. Letzteres ist möglich, weil es zum fast gänzlichen Abregen eines Moleküls nur einer endlichen Intensität bedarf. Übersättigen der Abregung bedeutet also, dass eine höhere Intensität verwendet wird als die zu einer weitgehenden Abregung des Markers gebrauchte. Eine genaue Betrachtung zeigt, dass die Population des angeregten Zustands und somit die Fluoreszenz weitgehend exponentiell mit der Intensität des stimulierenden Lichtstrahls abnimmt. Wenn nun eine bestimmte Schwellenintensität überschritten ist, so ist der Restterm vernachlässigbar gering und das Abregen quasi komplett (Abb. 2 b). Dies ist in der in Abbildung 2 gezeigten Messung bei Intensitätswerten über 1 GigaWatt/cm2 der Fall.

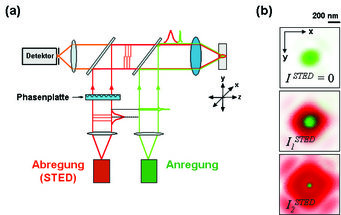
Anregung und anschließende Abregung lassen sich am besten mit Lichtpulsen von 1 ps bzw. 300 ps bewerkstelligen. So wird in einem typischen STED-Mikroskop das gepulste Anregungslicht und das Abregungslicht gleichzeitig in das Mikroskopobjektiv eingekoppelt (Abb. 3 a). Während das Anregungslicht erwartungsgemäß einen Lichtfleck (Spot) von > 200 nm im Durchmesser hervorbringt, wird das zur Abregung stimulierende Licht so modifiziert, dass es einen Ring im Außenbereich des Anregungsspots ausbildet, der in der Mitte über eine Nullstelle verfügt (Abb. 3 b). Fluoreszenz aus dem Randbereich des beugungsbegrenzten Anregungs-Spots wird durch den Abregungslichtpuls verhindert, während sie in der Nullstelle erhalten bleibt. Der Bereich, in dem die Fluoreszenz noch möglich ist, wird bei zunehmend intensiverem Licht immer weiter eingeschnürt (Abb. 3 b). Rastert man den derart verkleinerten Spot durch die Probe, dann liefert das punktweise registrierte Fluoreszenzlicht ein deutlich schärferes Bild als ein Mikroskop, das mit einem beugungsbegrenzten und daher größeren Spot abbilden würde.
Die Fähigkeit, das Bild durch Rastern zu gewinnen, ist durch die Reversibilität des Prozesses gewährleistet. Moleküle, die einmal abgeregt wurden, können vom nächsten Anregungspuls wieder angeregt werden, um anschließend zu fluoreszieren oder doch wieder abgeregt zu werden. Fluoreszenz findet statt, wenn der rasternde Nullpunkt sich gerade an ihrer Stelle befindet, sonst wird die Fluoreszenz unterdrückt. Berechnungen zeigen, dass die Größe des Spots und damit die Auflösung einem neuen Gesetz folgt:
Δd ≥ λ/2n sin α √ 1+ I/Isat. Dabei ist Isat die so genannte Sättigungsintensität, d.h. eine Art Schwelle, bei der die Fluoreszenz eines Moleküls mit einer gewissen Wahrscheinlichkeit (50%) verhindert wird. Isat ist charakteristisch für den verwendeten Farbstoff. Erhöht man den Wert I/Isat, so verbessert sich auch die Auflösung kontinuierlich. Lässt man die stimulierte Emission weg (I=0), so erhält man wie bisher die von Abbe vorhergesagte klassische Auflösungsgrenze.

Entscheidend anders ist aber nun, dass im Gegensatz zu Abbes Formel (Abb. 1) Δd nicht nach unten (auf ca. 200 nm) begrenzt ist. Im Gegenteil, für I/Isat → ∞ folgt Δd → 0. Durch Steigerung von I/Isat kann also die Größe des Spots beliebig verkleinert werden, was die Auflösung beliebig vergrößert.
Abbildung 4 vergleicht den herkömmlichen Fluoreszenz-Spot (rechts) mit dem durch STED verschärften (links). Bei der hier verwendeten Intensität I wurde der Durchmesser Δd des Spots von beugungsbegrenzten 254 nm auf 48 nm verkleinert, das heißt der Lichtfleck wurde in x- und y-Richtung um das Fünffache verschärft. Der Vergleich zeigt eindrucksvoll, wie die Beugungsgrenze mit Hilfe eines (reversiblen) sättigbaren Übergangs – hier der stimulierten Emission – überwunden wurde.
Dabei behält das STED-Mikroskop so gut wie alle Vorteile des konfokalen Fluoreszenzmikroskops bei. Es ist grundsätzlich 3D-fähig und funktioniert unter normalen Umgebungsbedingungen.

Anwendungen finden sich sowohl bei der Erforschung nanoskaliger Bestandteile der Zelle als auch bei künstlich nanostrukturierten Materialien. Beispiele für die vielseitige Anwendbarkeit zeigt Abbildung 5. Die beiden oberen Bilder zeigen die räumliche Verteilung eines fluoreszenzmarkierten Proteins auf der Zellmembran. Die Aufnahme mit dem STED-Verfahren (rechts) weist eine wesentlich größere Detailfülle auf als das herkömmlich aufgelöste Referenzbild. Das dabei abgebildete Protein Syntaxin, dessen Verteilung hier erstmals auf der Nanoskala aufgelöst ist, spielt eine wichtige Rolle bei der Verschmelzung von Vesikeln mit der Zellmembran.
Das Beispiel in der unteren Reihe demonstriert den Auflösungsgewinn an einer lithographischen Nanostruktur, wie sie als Zwischenschritt bei der Herstellung von Computerschaltkreisen üblich ist. Die mit einem Elektronenstrahl in einem Photolack hergestellten Linienmuster können selbst bei Strukturfeinheiten

Da prinzipiell nichts gegen eine weitere Auflösungssteigerung durch Optimierung der Abbildungsparameter spricht, kann in Zukunft mit noch schärferen Bildern der STED-Mikroskopie gerechnet werden. In der Tat ist es den Göttinger Wissenschaftlern kürzlich gelungen zu zeigen, dass unter realistischen experimentellen Bedingungen die Spotgröße sogar bis zu λ/ 50 reduziert werden kann, was in diesem Fall 16 nm betrug. Die Fähigkeit, Auflösungen dieser Größenordnung zu erzielen, wurden bisher fast nur der Elektronenmikroskopie und der Rastersondenmikroskopie zugeschrieben.
STED ist aber nur eine – wenn auch die erste und zurzeit die am besten erforschte – Variante des RESOLFT-Konzepts. Andere Varianten, die etwa den Farbstoff sättigend in einen Dunkelzustand überführen, z. B. in einen Triplett-Zustand oder in einen dunklen Konformationszustand, zeigen laut Berechnungen ein ebenso hohes Potential, die Beugungsgrenze zu durchbrechen. Das Gleiche gilt auch für Varianten, die optisch bistabile Moleküle reversibel von einem ersten in einen zweiten Zustand schalten. Mehr noch, weil ihre zu erwartenden Isat-Werte um Größenordnungen niedriger sind als bei STED, sind selbst bei um 4-8 Größenordnungen geringeren Intensitäten Auflösungen von einigen wenigen Nanometern zu erwarten.
Ein Beispiel dafür sind fluoreszierende Proteine, welche – eine vollständige Kontrolle des sättigbaren Übergangs vorausgesetzt – sogar bei Beleuchtung der Probe mit herkömmlichen Lampen Auflösungen im Nanometerbereich versprechen. In der Lichtmikroskopie ist damit in den letzten Jahren unerwartet ein Fenster aufgestoßen worden, das in Zukunft einen beugungsunbegrenzten Blick in die Nanowelt eröffnen wird.