Forschungsbericht 2004 - Max-Planck-Institut für Immunbiologie und Epigenetik
Die Rolle von Lipopolysaccharid im Wechselspiel zwischen Bakterien und Immunsystem
The role of lipopolysaccharid in the interplay between bacteria and the immune system
Metschnikoff Laboratorium (Prof. Dr. Markus Simon)
MPI für Immunbiologie, Freiburg
Einleitung
Das Überleben jedes höher entwickelten Organismus, auch das des Menschen, hängt entscheidend von dessen Fähigkeit ab, eine enorme Vielzahl infektiöser Mikroorganismen – dies sind Bakterien, Viren, Pilze und so genannte eukaryotische Parasiten – zu erkennen und zu vernichten. Die hierfür notwendigen Mechanismen entwickelten sich folgerichtig bereits während einer sehr frühen Phase der Evolution. In ihrer Gesamtheit werden diese, unser Überleben sichernden Mechanismen heute als angeborene Immunität bezeichnet. Zellen, wie zum Beispiel Monozyten, Gewebemakrophagen, Granulozyten und dendritische Zellen, spielen dabei eine tragende Rolle. Sie erkennen infektiöse Keime und lösen bei Gefahr mithilfe von Zell-gebundenen und löslichen Botenstoffen im Wirtsorganismus eine rasche Alarmreaktion aus. Die Freiburger Arbeitsgruppe um Marina A. Freudenberg erforscht diese Alarmreaktion – ihre Prozesse und Akteure sowie deren Kommunikationswege und Abwehrmechanismen im Überlebenskampf.
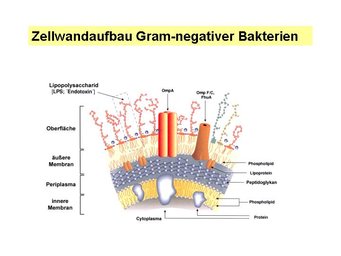
Im Mittelpunkt: Lipopolysaccharid
Ein erheblicher Teil der Infektionskrankheiten, etwa Keuchhusten, Magengeschwür, Typhus, Cholera oder Ruhr, wird durch so genannte Gram-negative Bakterien hervorgerufen. Im Mittelpunkt des Interesses steht dabei ein spezieller, großmolekularer Bestandteil der Oberfläche dieser Bakterien: das bakterielle Lipopolysaccharid, dessen Freisetzung während einer Infektion zu Krankheitssymptomen wie Fieber, Kopfschmerzen, Übelkeit und Erbrechen führt; oder bei ungünstigerem Verlauf der Krankheit zu einer toxischen Schockreaktion, dem häufig tödlichen Endotoxinschock, einer in der Humanmedizin gefürchteten Komplikation Gram-negativer Infektionen. Die Freisetzung des Lipopolysaccharids durch Bakterien, seine Interaktion mit LPS-bindenden Plasmaproteinen und Zellen, dadurch ausgelöste biologische Aktivitäten sowie das metabolische Schicksal des LPS im Wirtsorganismus wurden auch schon in der Vergangenheit durch Marina A. Freudenberg, Chris Galanos und deren Mitarbeiter untersucht. Heute stehen für die Freiburger Wissenschaftler eine Reihe neuer Fragen und Aspekte der LPS-Forschung im Vordergrund, deren umfassende Klärung und Erklärung eine direkte Auswirkung auf Diagnostik und Therapie bakterieller Infektionen und somit auf Überleben und Gesundheit einer Vielzahl von Patienten haben werden: Schwerpunkt der Forschung sind die LPS-spezifischen zellulären Rezeptoren sowie Veränderungen der LPS-Empfindlichkeit im infizierten Organismus und die Auswirkungen auf dessen Funktionsfähigkeit.

Lipopolysaccharid-Erkennung
Säugetiere stellen für die LPS-Forschung wichtige Modelle dar, insbesondere da es oft möglich ist, die gewonnenen Kenntnisse direkt auf den Menschen zu übertragen. Dabei ist vor allem das Mausmodell von Bedeutung. In der Spezies Maus sind natürliche Mutanten bekannt, die nicht auf LPS reagieren und keinen Endotoxinschock entwickeln. Mithilfe dieser Mutanten konnte die Freiburger Arbeitsgruppe die zentrale Rolle von Makrophagen in der LPS-Erkennung bei der Entstehung eines Endotoxinschocks beweisen. Des Weiteren führten Untersuchungen an LPS-resistenten Mutanten, unter Beteiligung der Freiburger Wissenschaftler, zu der Erkenntnis, dass das Oberflächenprotein Toll-like-Rezeptor 4 (TLR4) den zentralen Bestandteil des LPS-Rezeptors darstellt [1]. TLR4 ist ein Mitglied der Familie der Toll-like-Rezeptoren, welchen generell eine bedeutende Rolle bei der Erkennung von Krankheitserregern durch das Immunsystem zukommt. Die Wissenschaftler konnten zeigen, dass dieser Rezeptor für die Aktivierung von Zellen durch LPS unentbehrlich ist und dass die Empfindlichkeit der Zellen gegenüber LPS von der Anzahl der TLR4-Moleküle auf der Zelloberfläche abhängt.
Die Lipopolysaccharid-Erkennung durch Zellen wird durch die LPS-bindenden Plasmaproteine LBP und lösliches sCD14 sowie durch das Oberflächenprotein mCD14 unterstützt. Die Forschungsergebnisse zeigen, dass die Notwendigkeit dieser Erkennungshilfe stark von der LPS-Struktur abhängt. Das LPS-Molekül besteht aus einem Lipid- und einem Zuckerteil. Der hydrophobe Lipidteil, das so genannte Lipid A, ist bei allen biologisch-aktiven Lipopolysacchariden strukturell sehr ähnlich. Der hydrophile Zuckerteil dagegen variiert stark bei den verschiedenen Bakterienarten; dies sowohl in der Größe als auch in der Zusammensetzung. In einer Kooperation mit Forschern der Universität Freiburg um Michael Huber und amerikanischen Kollegen um Bruce Beutler konnten die Max-Planck-Wisssenschaftler nachweisen, dass die Abhängigkeit von einer LBP/CD14-Unterstützung bei der Aktivierung von Zellen durch LPS je nach LPS-Struktur von total abhängig bis hin zu weitgehend unabhängig schwankt [2]. Es wird erwartet, dass die letzteren Lipopolysaccharide ein größeres Repertoire an Zielzellen aufweisen und ihre Aktivität weitgehend von LBP- und CD14-Mutationen unabhängig ist.
LPS-Überempfindlichkeit durch Infektion
Untersuchungen im Mausmodell zeigten außerdem, dass die LPS-Empfindlichkeit während vieler experimenteller Infektionen stark ansteigt. Man spricht dann von einer Überempfindlichkeit [3]. LPS-überempfindliche Tiere produzieren als Antwort auf einen LPS-Stimulus stark erhöhte Mengen an Botenstoffen, inklusive Zytokinen. Die für die Erzeugung eines Endotoxinschocks benötigte Dosis an LPS nimmt in überempfindlichen Tieren drastisch ab. Gleichzeitig werden diese auch überempfindlich gegenüber der toxischen Wirkung des LPS-erzeugten Zytokins Tumor necrosis factor-α. Die Wissenschaftler zeigten, dass die Bildung des Zytokins Interferon-γ im infizierten Organismus für die Entstehung einer LPS-Überempfindlichkeit verantwortlich ist. Diese Entstehung wird durch das Freiburger Forscherteam gegenwärtig in verschiedenen Infektionsmodellen sowohl mit Gram-negativen als auch mit Gram-positiven Bakterien untersucht. Ein besonders gut geeignetes und etabliertes Modell zur Untersuchung der LPS-Überempfindlichkeit ist hierbei die Behandlung von Mäusen mit hitze-abgetöteten Gram-positiven Bakterien der Spezies Propionibakterium acnes. Die Arbeiten am MPI für Immunbiologie führten zu der Erkenntnis, dass ein weiteres Protein der Toll-like-Rezeptor-Familie, das TLR9, für die Entstehung einer LPS-Überempfindlichkeit durch Propionibakterium acnes unentbehrlich ist [4]. Soweit heute bekannt ist, ist dieser Rezeptor auf die Erkennung bakterieller Erbsubstanz (DNA) spezialisiert. Die Ergebnisse zeigen, dass die Aktivierung eines bestimmten TLR-Rezeptors, des TLR9, die Aktivierbarkeit eines anderen Rezeptors, des LPS-spezifischen TLR4 enorm steigern kann. Dieser Mechanismus ermöglicht es, dass der Kontakt des Wirtsorganismus mit Propionibakterium acnes über die Steigerung der LPS-Empfindlichkeit die Erkennung von Gram-negativen Bakterien allgemein verbessert. Beim Menschen stellt das Propionibakterium acnes einen Teil der physiologischen Besiedlung der Haut und der Schleimhäute mit Mikroorganismen dar. Die heutige Forschung geht davon aus, dass der enge Kontakt der physiologischen Flora mit dem angeborenen Immunsystem zu einer Dauerstimulierung des Systems führt. Dies ist für Menschen und andere Säugetiere sehr wichtig, da es eine effiziente Erkennung und schnelle Beseitigung von Infektionserregern fördert.
LPS-Empfindlichkeit: ein zweischneidiges Schwert
Untersuchungen an Lipopolysaccharid-resistenten Mäusen haben gezeigt, dass die LPS-Erkennung für die erfolgreiche Abwehr von Gram-negativen Infektionen unentbehrlich ist. Marina A. Freudenberg und andere Forscher konnten demonstrieren, dass die Abwesenheit des LPS-Rezeptors TLR4 oder des LPS-bindenden Plasmaproteins LBP, die mit einer LPS-Resistenz einhergehen, eine sehr hohe Empfindlichkeit gegenüber Infektionen wie dem Mäuse-Typhus verursachen. Freudenberg und ihre Mitarbeiter führten – zum Teil in Zusammenarbeit mit Kollegen aus dem Freiburger MPI um Markus Simon – Untersuchungen zu der Frage durch, wie sich eine LPS-Überempfindlichkeit auf die Infektionsresistenz sowie auf das Risiko der Entstehung eines Endotoxinschocks auswirkt. Die Forscher fanden in diversen Infektionsmodellen, dass, abhängig von der Höhe der LPS-Empfindlichkeit und der Anzahl der Infektionserreger, eine bestehende LPS-Überempfindlichkeit sowohl die Infektionsresistenz als auch das Risiko eines Endotoxinschocks im Versuchstier um ein Vielfaches steigern kann.
Am Freiburger Max-Planck-Institut werden die Untersuchungen zur Interaktion zwischen Mikroorganismen beziehungsweise ihren Bestandteilen auf der einen Seite und dem Wirtsorganismus auf der anderen Seite sowie der Bedeutung dieser Wechselwirkung für den Wirt auch künftig fortgeführt werden. Die Humanmedizin erwartet von den Erkenntnissen eine erheblich verbesserte Vorbeugung, Erkennung und Therapie von Infektionen und ihren Folgekrankheiten sowie des Endotoxinschocks.