Forschungsbericht 2003 - Max-Planck-Institut für experimentelle Endokrinologie
Molekulare Mechanismen zirkadianer Uhren
Molecular Mechanisms of Circadian Clocks
Molekulare Embryologie (Gregor Eichele)
MPI für experimentelle Endokrinologie, Hannover
Alles Leben auf der Erde ist direkt oder indirekt abhängig vom Energiespender Licht. Deshalb haben sich die meisten Lebewesen, von einfachsten Organismen wie Cyanobakterien und Schimmelpilzen bis hin zu Säugetieren, im Laufe der Evolution dem rhythmischen Wechsel von Tag und Nacht angepasst: So genannte innere Uhren steuern alle wichtigen Lebensfunktionen wie den Stoffwechsel, das Hormon- und Immunsystem sowie das Verhalten im tagesperiodischen Wechsel. Der 24-Stunden-Rhythmus dieses inneren Schrittmachers wird allerdings nicht von externen Zeitinformationen gesteuert. Das zirkadiane System (von "circa", lat. ungefähr und "dies", lat. der Tag) funktioniert auch in deren Abwesenheit, also ohne jegliche Beeinflussung durch äußere Faktoren: Es ist genetisch determiniert. Interessanterweise beträgt die Periodenlänge unter konstanten Bedingungen nicht genau 24 Stunden. Bei Mäusen beträgt sie in konstanter Dunkelheit im Schnitt nur 23,7 Stunden, während die innere Uhr des Menschen langsamer läuft (24,5 bis 25,0 h). Dies bedeutet, dass der interne Schrittmacher jeden Tag verstellt werden muss - zurück bei Mäusen, nach vorne beim Menschen -, um weiterhin synchron zum externen Tag-Nacht-Rhythmus zu laufen. Dies geschieht über Zeitgeber, externe Stimuli, welche Informationen über die Tageszeit an den Körper vermitteln. Der wichtigste Zeitgeber für Säugetiere ist das Licht. Aber auch Faktoren wie Temperatur, Aktivität und soziale Interaktion können den zirkadianen Rhythmus verschieben. Spezielle Lichtrezeptoren in der Netzhaut leiten Lichtinformationen über besondere Nervenbahnen direkt an die zentrale innere Uhr im Nucleus suprachiasmaticus (SCN) weiter, einem kleinen paarigen Hirnbereich von wenigen tausend Zellen direkt oberhalb des Chiasma opticus, der Kreuzungsstelle der beiden Sehnerven.
Das molekulare Uhrwerk
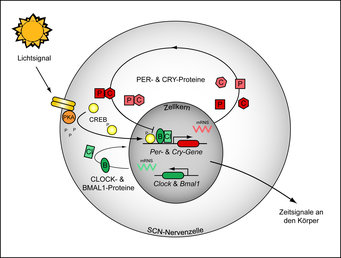
Auf molekularer Ebene wird das Lichtsignal über die Ausschüttung neuronaler Botenstoffe an den SCN weitergeleitet. Spezielle Rezeptoren auf der Zelloberfläche bestimmter SCN-Neuronen aktivieren je nach Tageszeit beziehungsweise Phasenlage der inneren Uhr unterschiedliche Signalkaskaden, unter anderem den Proteinkinase A (PKA)-Signalweg. Das führt zu einer Aktivierung des cAMP responsive element binding proteins (CREB), welches an die Promotoren zentraler Uhrengene bindet und diese aktiviert (Abb. 1). Inzwischen ist ein ganzer Kanon dieser Uhrengene in vielen Organismen identifiziert worden. Zwar bestehen Unterschiede in der Struktur dieser Gene zwischen den verschiedenen Stämmen des Tier- und Pflanzenreichs, ihre Interaktion und damit die Organisation des zirkadianen Uhrwerks scheint aber über alle Spezies konserviert. In miteinander gekoppelten Rückkopplungsschleifen regulieren die Uhrengene ihre eigene Transkription in einem 24-Stunden-Rhythmus. Die positiven Elemente dieser Rückkopplungsschleife bei Säugetieren (und damit auch beim Menschen) bilden die Transkriptionsfaktoren Clock und Bmal1. Sie aktivieren die Gene der negativen Faktoren wie Period 1 & 2 sowie Cryptochrome 1 & 2. Die Period- und Cryptochrome-Proteine bilden Komplexe, die vom Zytoplasma in den Zellkern translozieren, dort mit Clock und Bmal1 interagieren und deren Funktion und damit die Aktivierung ihrer eigenen Gene hemmen. So kommt es zu einer periodischen transkriptionellen Aktivierung und Deaktivierung im 24-Stunden-Takt. Die Period-Gene sind zum Beispiel immer am Tage aktiv, während die Bmal1-Transkription primär in der Nacht erfolgt.

Jede Zelle hat eine Uhr
Prinzipiell verfügt (fast) jede Zelle unseres Organismus über alle Zahnräder, die zur Funktion des inneren Uhrwerks benötigt werden. Allerdings sind nicht alle diese Uhren einander gleichgestellt. Stattdessen gibt es eine klare Hierarchie, die sicherstellt, dass unter normalen Bedingungen alle Uhren des Körpers die gleiche Zeit anzeigen. Der SCN als Referenzschrittmacher gehört zum Hypothalamus, der wichtige Teile unseres Hormonsystems und des Verhaltens kontrolliert. Über neuronale und humorale Faktoren, deren Natur noch nicht genau definiert ist, synchronisiert der SCN die peripheren Uhren in anderen Regionen des Nervensystems (wie zum Beispiel der Netzhaut) und im gesamten Körper (zum Beispiel in der Leber oder der Niere).
Defekte im molekularen Mechanismus der inneren Uhr können Ursache sein für Hormon- und Schlafstörungen, Konzentrationsschwächen und Depressionen. Lösungsansätze für diese Probleme setzen ein besseres Verständnis der inneren Uhren voraus. Wie funktionieren diese endogenen Oszillatoren auf molekularer Ebene, wie sind sie mit der Umwelt und dem Rest des Körpers verknüpft und was passiert, wenn sie aus dem Takt geraten? Ein Schwerpunkt der Forschungsarbeiten am Institut ist deshalb die Identifikation und Analyse der molekularen Komponenten der inneren Uhr. Vladimira Jakubcakova und Pablo Szendro beschäftigen sich primär mit der Frage, wie der Organismus die innere Uhr mit der externen Zeit synchronisieren kann. In einem anderen Projekt untersuchen Johanna Rose und Henrik Oster, wie diese Zeitsignale von der inneren Uhr verarbeitet und an den Körper weitergegeben werden.
Die Abstimmung der inneren Uhr mit der externen Zeit
Auf einer Reise in eine andere Zeitzone fühlen wir uns die ersten Tage oft schwach und antriebslos, wir leiden unter Jetlag. Nach einiger Zeit legt sich das wieder, unsere innere Uhr hat sich an den neuen Tag-Nacht-Rhythmus angepasst. Auch auf die unterschiedlichen Tageslängen im Verlaufe des Jahres muss sich die innere Uhr einstellen. Auf zellulärer Ebene sorgt zum Beispiel Lichteinfall im Auge zu bestimmten Zeiten des Tages für die Aktivierung von Genen in der Netzhaut. Von dort wird über die Sehnerven ein Signal an die zentrale innere Uhr des Gehirns weitergeleitet, wo licht-sensitive Uhrengene, beispielsweise Period 1 und 2, aktiviert werden, die wiederum das Laufverhalten der Uhr (also die Aktivierung anderer Uhrengene wie der Cryptochrome oder Bmal1) modulieren, wie Gregor Eichele und Urs Albrecht in Kollaboration mit Cheng Chi Lee am Baylor College of Medicine in Houston, Texas, herausfanden.
Neue Gene im Stellwerk der inneren Uhr
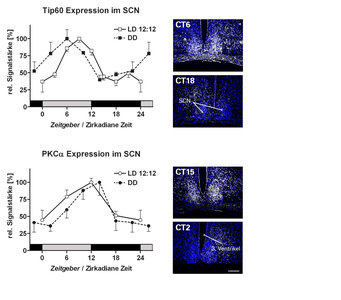
Durch Protein-Protein-Interaktionsstudien in Hefezellen konnten Pablo Szendro und Cristina Cadenas neue Cryptochrome-Bindungspartner identifizieren. Zwei Beispiele sind das tat-interactive 60 kDa protein (Tip60) sowie die α-Isoform der Protein Kinase C (PKCα). Beide Gene zeigen sowohl unter 12 h Licht: 12 h Dunkel-Bedingungen (LD) als auch in konstanter Dunkelheit (DD) eine rhythmische Gen-Expression im SCN, das heißt sie stehen unter direkter Kontrolle der inneren Uhr (Abb. 2).

Tip60 reguliert die Lichtempfindlichkeit des inneren Uhrwerks
Es gibt zwei Varianten von Tip60, α und β. Beide binden direkt an die Cryptochrome 1 und 2 sowie an Period 2, wobei die Bindungsdomänen für die Chryptochrome im C-, die für Period im N-terminalen Teil des Proteins lokalisiert sind. Um zu testen, ob Tip60 durch diese Interaktion an der Rückkopplung der Uhrenproteine auf ihre eigene Gen-Expression beteiligt ist, wurde ein spezielles Reportergen-System etabliert: Mithilfe des Luziferase-Proteins kann ein Einfluss auf die transkriptionelle Aktivierung des Period 1-Gens durch Clock und Bmal1 untersucht werden. Tatsächlich konnte Dr. Szendro zeigen, dass die Zugabe von unterschiedlichen Mengen an Tip60 eine graduierte Inhibition des Aktivatorpotentials von Clock/ Bmal1 bewirkt.
Es ist zudem bekannt, dass Tip60 die Phosphorylierung und Aktivierung des CREB-Proteins durch die Proteinkinase A (PKA) unterdrücken kann. Die Aktivierung von PKA und Phosphorylierung von CREB jedoch sind essentielle Komponenten des Lichtsignalweges zur inneren Uhr, mit dessen Hilfe die Phase des Rhythmus der zentralen Uhrengene an externe Bedingungen angepasst wird (siehe oben). Die Verknüpfung von molekularem Uhrwerk und Lichtsignalisation über Tip60 ermöglicht es der inneren Uhr, ihre Sensitivität für externe Zeitgeber tagesperiodisch zu variieren. So kann sie beispielsweise auf Lichtexposition nur zu bestimmten Zeiten in der Nacht mit einer Phasenverschiebung der Uhrengen-Transkription reagieren. Fortlaufende Experimente zielen auf die Validierung dieser Resultate in vivo. Außerdem soll geklärt werden, welchen Einfluss weitere Eigenschaften von Tip60 - wie seine Azetyltransferaseaktivität - auf das zirkadiane System haben.
PKCs halten Uhrenproteine aus dem Zellkern
Für die Proteinkinase Cα ist schon seit längerem eine Verbindung zum Mechanismus der inneren Uhr bekannt. Da in der Arbeitsgruppe "Signaltransduktion" (Michael Leitges) in einem anderen Kontext PKCα-defiziente Mäuse generiert worden waren, konnte der Einfluss dieser PKC-Isoform auf das zirkadiane System erstmals in vivo untersucht werden. Dabei stellten Vladimira Jakubcakova und Henrik Oster fest, dass der innere Rhythmus dieser Tiere unter LD- und DD-Bedingungen nicht von dem entsprechender Wildtyp-Kontrolltiere zu unterscheiden ist. Allerdings zeigen PKCα-Mutanten eine verminderte Reaktion auf phasenverschiebende Lichtpulse zu Beginn der Nacht (Abb. 3). Dies war ein Hinweis darauf, dass PKCα - im Gegensatz zu Tip60 - nicht im zentralen Uhrwerk selber, jedoch im Lichtsignalweg eine Rolle spielt. Eine Untersuchung der Lichtinduktion unter anderem der Period-Gene zeigte allerdings, dass diese in den Mutanten in vergleichbarem Maße wie in Wildtypen durch Licht aktiviert werden. Über Protein-Protein-Interaktionsstudien sowie Ko-Expressionsexperimente in verschiedenen Zellkultursystemen konnten die Wissenschaftler jedoch einen neuartigen Interaktionsmechanismus zwischen Lichtsignal und zentralem Oszillator postulieren: Period 2-Protein wird durch PKCα phosphoryliert und im Zytoplasma zurückgehalten; dadurch wird der Lauf der inneren Uhr nach nächtlicher Lichtgabe verlangsamt. Das daraus resultierende verzögerte Anfluten von Period-Cryptochrome-Komplexen im Zellkern bewirkt so - zusätzlich zur direkten Induktion der Period-Transkription - eine Phasenverschiebung. Diese zusätzliche Verschiebung ist in den PKCα-defizienten Tieren aufgehoben, wodurch es zu einer verminderten Reaktion auf Lichtexposition kommt. Expressionstudien haben gezeigt, dass noch zwei weitere PKC-Isoformen im SCN der Maus exprimiert sind, PKCβ und γ. Aktuelle Studien mit den entsprechenden Mutanten sollen zeigen, inwieweit diese Gene und deren Proteine im zirkadianen System eine Rolle spielen.

Der SCN steuert die Uhren des Körpers
Die Entdeckung peripherer Uhren hat zu einem Paradigmenwechsel auf dem Gebiet der Chronobiologie geführt. Statt sich ausschließlich mit der Funktion des SCN zu beschäftigen, wird nunmehr verstärkt das Zusammenspiel zwischen den einzelnen Uhren des Körpers und dem zentralen Schrittmacher sowie der Einfluss lokaler Uhren auf bestimmte Aspekte der Physiologie des Organismus untersucht. In diesem Zusammenhang hat Johanna Rose zusammen mit Serge Daan von der Universität Groningen in den Niederlanden ein Projekt zur Analyse extrahypothalamischer Oszillatoren im zentralen Nervensystem initiiert. Mithilfe des am Institut entwickelten Verfahrens zur Hochdurchsatz-Gen-Expressionsanalyse per In-situ-Hybridisierung (GenePaint, siehe Bericht 2002) hat sie die tagesperiodische Expression von zehn verschiedenen Uhren- und Uhren-kontrollierten Genen im gesamten adulten Mausgehirn unter verschiedenen Lichtbedingungen (LD, DD, Langtag, Kurztag sowie LD mit Dämmerungssimulation) untersucht. Dabei wurden Transkriptionsrhythmen in verschiedenen Hirnarealen wie Hippocampus, Kleinhirn, Hirnrinde sowie einigen Kernen des Vorderhirns und des Stammhirns identifiziert (als Beispiel siehe Abb. 4). Viele dieser Zentren stehen in Zusammenhang mit wichtigen sensomotorischen und kognitiven Funktionen. Eine genauere Analyse dieser Oszillatoren und der von ihnen kontrollierten Parameter soll Aufschluss geben über Einflüsse der inneren Uhr auf die zugeordneten Hirnfunktionen. Dies könnte zudem wichtige Hinweise zu Entwicklung und Verlauf neurologischer Erkrankungen wie der Alzheimerschen oder der Parkinsonschen Krankheit liefern, in deren Zusammenhang über einen Einfluss durch beziehungsweise auf das zirkadiane System bereits berichtet wurde.