Zellulärer Stromausfall
Wissenschaftler entdecken Abbauweg für Proteine, der fehlerhafte Proteine zur Qualitätskontrolle in die Mitochondrien leitet
Ein gemeinsames Merkmal neurodegenerativer Erkrankungen wie Alzheimer, Parkinson oder der Huntington-Krankheit sind Ablagerungen verklumpter Proteine in den Nervenzellen. Wie Wissenschaftler des Max-Planck-Instituts für Biochemie und der Ludwig-Maximilians-Universität München jetzt berichten, produzieren auch gesunde Zellen kontinuierlich verklumpungsanfällige Proteine. Grund dafür sind reaktive Sauerstoffspezies, die bei der zellulären Energiegewinnung entstehen. Werden die fehlerhaften Proteine nicht rasch abgebaut, reichern sich Proteinverklumpungen vorwiegend in den Mitochondrien, den Kraftwerken der Zelle, an. Dort blockieren sie letztendlich die Energieproduktion. Damit Zellen toxische Aggregate beseitigen können, haben sie eine ausgeklügelte Proteinqualitätskontrolle entwickelt.

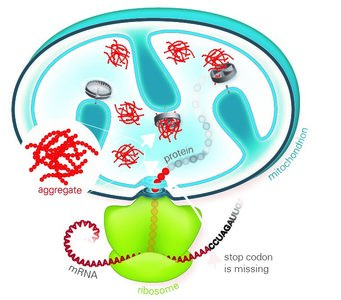
Fehlgefaltete Proteine sind oft klebrig und verklumpen. Die entstehenden Proteinaggregate gelten als Ursache verschiedener Krankheiten. Deshalb besitzen Zellen eine Proteinqualitätskontrolle, die fehlerhafte Proteine erkennt und schnell abbaut. Proteine werden in Ribosomen produziert. Die Ribosomen können blockieren und fehlgefaltete Proteine herstellen, wenn sie einen defekten Bauplan ablesen. Entfernt die Ribosomen-assoziierte Qualitätskontrolle (RQC) die fehlerhaften Proteine nicht richtig, reichern sie sich als Aggregate im Zytoplasma der Zelle an. Eine frühere Studie hat gezeigt, dass sogenannte CAT-Sequenzen, C-terminale Alanin-Threonin-Sequenzen, zur Verklumpung beitragen. CAT-Sequenzen werden an das Ende defekter Proteine angeheftet. Diese werden dann abgebaut.
In früheren Studien haben Wissenschaftler untersucht, wie die RQC blockierte Ribosomen im Zytoplasma erkennt und die verklebten Proteine entfernt. Ein gemeinsames Forscherteam des Max-Planck-Instituts für Biochemie und der Ludwig-Maximilians-Universität beschreiben jetzt, wie die RQC verstopfte Ribosomen von fehlerhaften Proteinen, die für die Mitochondrien bestimmt sind, befreit.
Mitochondrien sind die Kraftwerke der Zellen. Die kleinen Zellorganellen wandeln die Energie aus der Nahrung in ATP um. ATP ist als universelle „Energiewährung“ der Zelle essentiell für alle Prozesse im Organismus. Der Ausfall der leistungsfähigen Kraftwerke hat fatale Folgen. Schäden an den Mitochondrien spielen nicht nur eine Rolle bei der Entstehung von Stoffwechselerkrankungen wie Diabetes, sondern auch von neurodegenerativen Erkrankungen. „Deswegen werden die Mitochondrien auch als ‚Achillesferse‘ der Zelle bezeichnet“, sagt Walter Neupert aus der Abteilung für Zellbiologie am Biomedizinischen Centrum der Ludwig-Maximilians-Universität.
Fehlerhafte Proteine in den Mitochondrien
Neupert und sein Team untersuchen seit Jahren die Mitochondrien. Sie haben gezeigt, dass selbst gesunde, ungestresste Zellen kontinuierlich fehlerhafte Proteine produzieren. Die Atmungskette in den Mitochondrien setzt in einer Seitenreaktion reaktive Sauerstoffspezies frei, die die DNA, RNA und Proteine der Zellen schädigen. Um herauszufinden, wie solche toxischen Aggregate in den Mitochondrien entstehen und die Zellen schädigen können, kooperierte Neupert mit dem Team von F.-Ulrich Hartl. Hartl erforscht seit Langem die Entstehungsmechanismen von Proteinaggregaten, einer zellulären Ursache neurodegenerativer Erkrankungen.
„Proteine mit CAT-Sequenzen sind besonders toxisch für die Mitochondrien. Nach ihrem Import verklumpen sie rasch und bilden Ablagerungen. Diese Aggregate wirken wie ein Kristallisationskeim. Mit der Zeit verklumpen sie neben defekten auch funktionsfähige, lebenswichtige Proteine“, erklärt Toshiaki Izawa, Erstautor der Studie zusammen mit Sae-Hun Park. „Unter den betroffenen Proteinen sind auch mitochondriale Chaperone und Proteasen, Helferproteine, die geschädigte Proteine reparieren oder abbauen. Sind diese auch verklumpt, können sie nicht mehr arbeiten. Ein Teufelskreis beginnt. Letztendlich zerstören solche Aggregate die Mitochondrien und bringen die ATP-Produktion zum Erliegen. Der Zelle geht somit buchstäblich die Energie aus.
Der mitoRQC Abbauweg
„Im Zytoplasma ist der Abbau von mitochondrialen Proteinen, die mittels CAT-Sequenzen als fehlerhaft markiert wurden, erschwert. Die Herstellung dieser Proteine im Zytoplasma ist direkt an deren Import in die Mitochondrien gekoppelt. Deshalb haben Zellen eine andere Strategie entwickelt, um fehlerhafte mitochondriale Proteine zu beseitigen“, sagt Park. „Wir haben einen neuen Abbauweg namens mitoRQC gefunden. Dabei spielt das zytosolische Protein Vms1 eine Schlüsselrolle“, erklären die Autoren der Studie. Vms1 vermindert das Anhängen von CAT-Sequenzen an klebrige Proteine, die die Ribosomen blockieren. Anstatt zu verklumpen werden die fehlerhaften Proteine zur Qualitätskontrolle in den Mitochondrien geleitet. „Diese Erkenntnisse liefern wichtige, neue Einblicke in die Mechanismen der mitochondrialen Qualitätskontrolle. Unsere Ergebnisse zeigen, wie die Zellen Schäden der Mitochondrien vermeiden, die zur Entstehung neurodegenerativer Erkrankungen führen können“, fasst Hartl zusammen.
SiM/HR