Die Keimzelle der Biobatterie
Die Energieversorgung der Zukunft hat ein Speicherproblem. Um überschüssigen Strom von Windkraft- und Solaranlagen für Zeiten aufzuheben, in denen es zu wenig gibt, sind leistungsfähige Batterien und Kondensatoren gefragt, die aus möglichst ungiftigen und nachhaltigen Materialien bestehen sollten. Daran arbeiten Clemens Liedel und Martin Oschatz am Max-Planck-Institut für Kolloid- und Grenzflächenforschung in Potsdam.
Text: Karl Hübner

Ein Hauch von Vanille liegt in der Luft. Das würde man in einem Chemielabor nicht unbedingt erwarten. Schon gar nicht, wenn dort an Batteriematerialien geforscht wird. „Das kommt vom Vanillin“, sagt Clemens Liedel und schmunzelt. Aber wer sich jetzt darauf freut, dass ihm gleich Reste vom Weihnachtsgebäck oder von einem frisch gebackenen Geburtstagskuchen angeboten werden, wird enttäuscht. Keine Backwaren, nirgends. In Liedels Labor dient die Substanz derzeit als Ausgangsstoff für ein mögliches Elektrodenmaterial der Zukunft.
Clemens Liedel leitet am Max-Planck-Institut für Kolloid- und Grenzflächenforschung in Potsdam die Arbeitsgruppe „Nachhaltige Materialien für die Energiespeicherung“. Der Name ist Programm. Denn im besten Falle sollen diese neuen Batteriewerkstoffe aus nachwachsenden Rohstoffen und dabei nahezu unbegrenzt verfügbar sein. Für heutige Lithiumbatterien gilt genau das nicht. Lithium etwa ist ein eher seltenes Metall, von dem es weltweit nicht viele Lagerstätten gibt. In etwa zwei Dritteln aller Lithiumbatterien ist außerdem Kobalt im Einsatz, ein Metall, dessen Gewinnung häufig mit sozialen und ökologischen Verwerfungen in den Herkunftsländern einhergeht. Hinzu kommen Elektrolyte, die mitunter giftig oder auch brennbar sind. Angesichts des derzeit stark wachsenden Bedarfs an Speicherkapazität sind das noch keine optimalen Voraussetzungen.

Im Vanillin-Ansatz sieht Clemens Liedel eine deutlich nachhaltigere Alternative. Denn die Substanz lässt sich aus einem der häufigsten Stoffe überhaupt herstellen – aus Lignin, einer Hauptkomponente von Holz. Jahr für Jahr produziert die Natur viele Milliarden Tonnen davon.
Aber wie kann ein organisches Molekül als Material für einen Stromspeicher dienen? Schließlich denkt man bei Batterien eher an Metalle, etwa an Blei, Cadmium oder eben Lithium. „Was man braucht, sind ganz allgemein Substanzen, die Elektronen abgeben und danach auch wieder aufnehmen können“, erklärt Liedel. „Das können Metalle sein, die dann zu Metall-Ionen werden, aber auch organische Substanzen.“
Konkret schwebt den Potsdamer Forschern vor, statt schwermetallhaltiger Stoffe wie etwa Lithiumkobaltoxid Vanillin an der Kathode, also am Pluspol von Lithiumbatterien einzusetzen. Doch das ist nicht ganz einfach. Man kann ein sprödes Pulver wie oxidiertes Vanillin nicht einfach als Elektrodenmaterial verwenden. „Normalerweise vermengt man die Substanz mit einem Bindemittel zu einer kompakten Masse und macht diese durch Zusatz von Kohlenstoff noch leitfähig“, erklärt Liedel. Das habe auch funktioniert. Allerdings war der Ansatz dem Chemiker noch nicht nachhaltig genug. Das Bindemittel, ein fluorhaltiges Polymer, bereitete ihm noch Kopfschmerzen.
Zwischenzeitlich hatten die Potsdamer ihr Vanillin daher chemisch an das biobasierte Polymer Chitosan gebunden und das Ganze dann mit Rußpartikeln vermischt – ganz ohne Bindemittel. Chitosan ist ein zuckerähnliches Polymer, das sich zum Beispiel aus der Schale von Garnelen gewinnen lässt. Ruß wird derzeit zwar noch aus fossilen Brennstoffen gewonnen, ließe sich aber auch aus Biomasse herstellen. Ganz aktuell testen die Potsdamer ein reines Vanillin-Kohlenstoff-Gemisch, das nach einer chemischen Veränderung des Vanillins sowohl ohne Bindemittel als auch ohne Chitosan auskommt.
Eine nachhaltigere Lösung für Elektrolyte
Für den Test als Elektrodenmaterial trägt ein Mitarbeiter das Substanz-Gemisch hauchdünn auf Kohlepapier auf. Daraus stanzt er ein kleines kreisrundes Stück aus, das er in ein Kunststoffgehäuse bugsiert. Danach kommen noch eine Trennmembran, ein Elektrolyt und eine Gegenelektrode in die Kammer. Damit ist die Batterie komplett. An zwei Edelstahlzylindern, die aus dem Kunststoffgehäuse ragen, lässt sich nun die Batteriespannung messen. An diesem Tag sind es 3,1 Volt.

Die Wissenschaftler testen aber nicht nur das. „Wir machen immer auch Langzeittests, in denen sich Entlade- und Ladevorgänge abwechseln“, sagt Liedel. „So sehen wir, ob sich unsere Elektrode überhaupt für häufige Ladezyklen eignet.“ Für wiederaufladbare Batterien natürlich eine zwingende Voraussetzung. Auch dabei habe der jüngste Vanillin-Ansatz schon überzeugt.
Viele Gedanken macht sich die Gruppe von Clemens Liedel auch über künftige Elektrolyten. Der Elektrolyt ist jene Komponente in einer Batterie, die mit ihren beweglichen Ladungsträgern, den Ionen, für den elektrischen Ladungsausgleich zwischen den beiden Polbereichen sorgt. Üblicherweise besteht er aus einem an die Elektroden angepassten Leitsalz und einem Lösungsmittel. „Aktuell sind hier Lösungen giftiger Lithiumsalze in brennbaren organischen Carbonaten üblich“, erklärt Liedel. Dem Chemiker schwebt eine nachhaltigere und auch sicherere Lösung vor.
Auch dabei gibt es erste Erfolge. Clemens Liedel betritt ein weiteres seiner Labore, greift nach einem Rundkolben, schwenkt ihn kurz in der Luft, und schon sieht man eine farblose Masse zäh hin und her schwappen. „Das ist eine ionische Flüssigkeit“, sagt Liedel. So nennt man Salze, die schon bei Temperaturen unter 100 Grad Celsius flüssig sind. Wie für Salze kennzeichnend bestehen sie aus positiv geladenen Kationen und negativ geladenen Anionen. „Ionische Flüssigkeiten sind gut leitend für andere Ionen, kaum flüchtig und damit auch schwer entflammbar“, erklärt er, warum sich diese Stoffgruppe als Lösungsmittel für Elektrolyten empfiehlt.
Und: Ionische Flüssigkeiten gibt es auf rein organischer Basis; sie lassen sich somit im besten Falle aus nachwachsenden Rohstoffen gewinnen. Für Liedel ist noch etwas wichtig: „Sie sind chemisch gut designbar.“ So lässt sich sowohl die Ionenleitfähigkeit der Moleküle gut einstellen als auch der Temperaturbereich, in dem sie flüssig sind. Inzwischen hat seine Gruppe eine geeignete ionische Flüssigkeit gefunden, die sich bereits zur Hälfte aus nachwachsenden Rohstoffen herstellen lässt.
Hochzeit der Batteriekomponenten
In kommerziellen Batterien liegen die beiden Pole in der Regel dicht beieinander. Um einen elektrischen Kurzschluss zu vermeiden, befindet sich zwischen ihnen noch eine feinporige Trennwand. Dieser Separator ist für die Ionen des Elektrolyten durchlässig. Das erlaubt den Ladungsausgleich, der nötig ist, sobald Elektronen vom Minuspol über einen Verbraucher zum Pluspol wandern oder wenn die Batterie geladen wird.

Üblicherweise dienen erdölbasierte Kunststoffmembranen als Separator. Auch hier hat Liedels Gruppe schon eine Alternative im Angebot. Die hat sich bei den Arbeiten mit Chitosan, sozusagen ganz nebenbei, aufgetan. Die Forscher haben die Chitosan-Ketten durch den Zusatz weiterer Substanzen einfach zu einem Netzwerk an Makromolekülen mit kleinen Poren verknüpft. Versuche damit seien bereits erfolgreich gewesen. „Vor allem die Anionen wandern gut durch die Poren“, so Liedel.
Nach so viel Grundlagenforschung an einzelnen Batteriekomponenten schwebt der Gruppe nun der nächste große Schritt vor. „Jetzt wollen wir versuchen, alle Ansätze miteinander zu verheiraten“, formuliert es Liedel. Also das organische Kathodenmaterial mit der ionischen Flüssigkeit, der Chitosanmembran und einer Anode auf Natrium- oder Magnesiumbasis. „Wir müssen aber noch einige Detailfragen klären“, sagt Liedel. Etwa die, wie gut sich die ionische Flüssigkeit eigentlich mit einem biobasierten Elektrodenmaterial wie dem oxidierten Vanillin chemisch verträgt.
Dass polymerbasierte Batteriewerkstoffe derzeit als besonders aussichtsreich und nachhaltig gelten, zeigt auch ein im April 2019 gestartetes Schwerpunktprogramm der Deutschen Forschungsgemeinschaft. Sechs Jahre lang wird die DFG insgesamt zwölf Millionen Euro für ein entsprechendes Forschungsnetzwerk bereitstellen, zu dem auch die Gruppe von Clemens Liedel zählt.
Das einzige Batteriebauteil, zu dem Liedel bisher keine eigene Materialforschung macht, ist der Minuspol. Aktuell besteht diese Anode meistens aus einer Lithium-Graphit-Kombination. Zwar sind bereits andere Metalle wie Natrium oder Magnesium im Gespräch, die deutlich besser verfügbar und auch nachhaltiger wären. Allerdings gilt es noch eine Reihe technischer Fragen zu klären, ehe sie in der Praxis zum Einsatz kommen können.
Daran arbeitet auch Martin Oschatz. Der Institutskollege hat seine Labors nur wenige Schritte von denen Liedels entfernt. Er leitet die Arbeitsgruppe „Kohlenstoffnanomaterialien für umwelt- und energierelevante Anwendungen“, und zu diesen Anwendungen zählt auch der Einsatz in Stromspeichern. Oschatz tüftelt an Kohlenstoffmaterialien mit Poren von sehr genau definierter Größe. Grundsätzliches Ziel dabei: eine möglichst große Oberfläche mit möglichst vielen Stellen, an denen zum Beispiel Metallatome anhaften können. Genau das würde auch die Speicherdichte von Anoden verbessern.
Eine Anode liefert beim Entladen die Elektronen, indem in der Regel ein Metall diese abgibt und dann als positiv geladenes Ion, also als Kation vorliegt. Am einfachsten wären also Elektroden aus genau diesem Metall. Doch genau dies lässt sich bei manchen Metallen kaum realisieren. Lithium wird daher üblicherweise mit Graphit kombiniert, wobei die Lithiumatome zwischen den Kohlenstoffschichten des Graphits eingelagert werden.
Poröser Kohlenstoff für Superkondensatoren
Martin Oschatz arbeitet an einer ähnlichen Lösung für Natrium. „Die Einlagerung in Graphit funktioniert mit Natrium nicht“, sagt Oschatz. Der Kohlenstoffchemiker hat aber schon eine andere Lösung gefunden. Ein Kohlenstoffpolymer mit zwei wichtigen Besonderheiten: Das flächige Makromolekül bildet von sich aus siebartige Poren. Und: Am Rand dieser Poren haben die Chemiker durch geschickte Wahl der Ausgangsverbindungen Stickstoffatome eingebaut. „Diese sorgen dafür, dass Metallatome stabil eingelagert werden“, erklärt Oschatz.
Allerdings gab es erst einmal noch einen Haken. Der hohe Stickstoffanteil fördert zwar die Bindungskraft für Natrium, verschlechtert aber die Leitfähigkeit für die Elektronen, die das Natrium bei der Entladung abgibt. Ähnlich wie Liedel seine organischen Kathodenmaterialien musste auch Oschatz sein Polymer daher noch mit Ruß zusammenbringen, um zu einem tauglichen Elektrodenmaterial zu gelangen. Konkret beschichten die Potsdamer dazu hauchdünne Kohlenstofffäden mit ihrem Kohlenstoff-Stickstoff-Polymer. Die Speicherdichte ihres Materials sei für Natrium bereits relativ gut, sagt Oschatz nach ersten Tests.

Anders als Liedel hat Oschatz nicht nur Batterien im Blick. Das stickstoffreiche poröse Kohlenstoffpolymer habe sich daneben auch schon als Katalysatormaterial für die energieeffiziente Synthese von Ammoniak bewährt. Und weil die Poren gerade Kohlendioxid-Moleküle gut festhalten, eigne sich das Material darüber hinaus noch gut als CO2-Filter, etwa für die Rauchgasreinigung, so Oschatz zu weiteren umweltrelevanten Anwendungen.
Und auch bei der Stromspeicherung hat der Chemiker noch ein anderes Einsatzgebiet als Biobatterien im Blick. Er möchte hochporösen Kohlenstoff als Elektrodenmaterial in Superkondensatoren einsetzen. Die in ihnen gespeicherte Energie lässt sich sehr schnell abrufen. Darüber hinaus haben Kondensatoren in der Regel eine deutlich längere Lebensdauer als Batterien. Allerdings ist die Energiemenge, die sich in ihnen speichern lässt, bisher auch viel kleiner. Superkondensatoren kommen bereits dort zum Einsatz, wo kurzfristig große Strommengen benötigt werden, etwa beim Anfahren von Straßenbahnen. Auch manche Autos gewinnen Bremsenergie mit Superkondensatoren zurück.
Die Kondensatoren, mit denen sich Martin Oschatz beschäftigt, speichern elektrische Energie in einem elektrischen Feld, also indem zwei Elektroden entgegengesetzt aufgeladen werden. Um die Ladung auszugleichen, lagern sich jeweils entgegengesetzt geladene Ionen aus einem Elektrolyten an den Elektroden an. Wie viel Ladung ein Kondensator speichert und wie schnell er sich lädt beziehungsweise entlädt, hängt davon ab, wie schnell die Elektroden wie viele Ionen aufnehmen und abgeben.
Schon die derzeit in vielen Superkondensatoren übliche Aktivkohle verfügt mit rund 1500 Quadratmetern je Gramm über reichlich Kontakt zur Außenwelt. Doch Oschatz war damit nicht zufrieden. „Die Porosität von Aktivkohle ist aufgrund des Herstellprozesses eher zufällig und völlig ungeordnet“, sagt der Chemiker. Er möchte ein Material, dessen Oberflächenverlauf bis hinunter in den Bereich von Nanometern, also bis auf einige Millionstel Millimeter, klar definiert ist. Und zwar so, dass das Material beim Anlegen einer Spannung möglichst rasch möglichst viele Ionen aufnehmen – und auch wieder abgeben kann.
Ein Parkhaus für Ionen
Als besonders leistungsfähiges Elektrodenmaterial für die Energiespeicher setzt Martin Oschatz deshalb auf ein fast reines Kohlenstoffmaterial mit einer großen Oberfläche und einer ausgetüftelten Porenstruktur. Es kann viel mehr Ionen schneller binden und wieder freisetzen als der stickstoffhaltige Kohlenstoff, den Oschatz’ Gruppe für Natriumbatterien entwickelt hat. Das Elektrodenmaterial ist deshalb so leistungsfähig, weil es entlang seiner Kontaktflächen mit dem Elektrolyten genügend Poren gibt, die Ionen aufnehmen können, ohne dass sie danach andere Ionen blockieren. Oschatz spricht gerne von einer Art Parkhaus: „Wir brauchen viele Straßen, die als Zuwege fungieren, und entlang dieser Wege be- nötigen wir ausreichend Parkbuchten.“

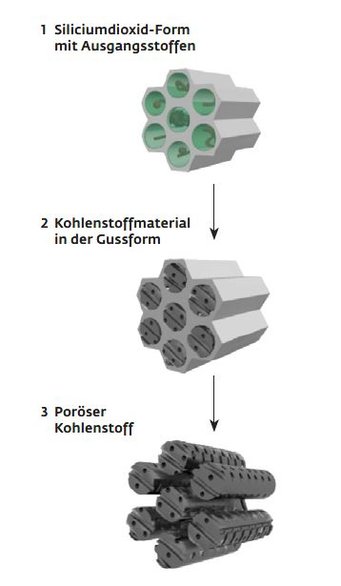
Um solche Nanoparkhäuser zu bauen, stellt das Team von Martin Oschatz aus einem speziellen Silicat zunächst eine Art winziger Backformen her, deren Hohlräume genau dem gewünschten Aufbau des Parkhauses entsprechen. Im Wesentlichen bestehen die Model aus unzähligen parallel angeordneten Röhren. Der Abstand zwischen benachbarten Röhren beträgt wenige Nanometer. Die Backformen füllen die Forscher mit einem Gemisch aus Zucker und Salz schieben das Ganze bei rund 800 Grad in den Ofen.
Unter Luftabschluss pyrolysiert der Zucker, zurück bleibt Kohle. Das Salz dagegen verdampft im Ofen und hinterlässt Hohlräume – die Parkbuchten für die Ionen. Über die Salzmenge steuern die Chemiker die Porengröße und können dabei Parkplätze in der Größenordnung von einem Nanometer oder sogar weniger zu formen. Anschließend lösen die Forscher die Backform chemisch auf, und zurück bleiben unzählige Kohlenstoffstäbchen, die jeweils über kleine Stege miteinander verbunden sind. „Die leeren Räume zwischen den Stäben sind dann unsere Straßen“, sagt Oschatz. Über sie erreichen die Ionen ihre Parkplätze.
Niedrigere Kosten je gespeicherter Kilowattstunde
Mit ihrer definiert designten Porosität bringen die Forscher es inzwischen auf eine spezifische Oberfläche von bis zu 3000 Quadratmetern je Gramm. Ein halbes Fußballfeld also in wenigen Krümeln Kohle. Die Größe der Oberfläche bestimmen sie mit einem Gerät, das misst, wie viele Teilchen eines Gases an eine bestimmte Menge ihrer Materialien binden. Daraus schließen sie auf die spezifische Oberfläche ihrer Substanzen.
Gemessen haben sie natürlich auch schon, wie schnell sich ihr Material lädt – und wieder entlädt. „Wir hatten bereits Proben, die zehnmal so schnell geladen und entladen werden konnten wie Aktivkohle“, sagt Oschatz. Auch die Speicherdichte habe die bisheriger Elektrodenmaterialien übertroffen.
Solche Ansätze verfolgt auch Sebastian Pohlmann mit Interesse. Er leitet die Material- und Zell-Entwicklung bei Skeleton Technologies, dem einzigen Hersteller von Superkondensatoren in Europa, und tüftelt am Standort Großröhrsdorf selbst an Elektroden mit besseren Eigenschaften. „Mehr Ordnung in die Struktur der Porosität zu bringen, ist hierbei ganz wichtig“, so Pohlmann.
Und was ist mit der Nachhaltigkeit? Auf den ersten Blick erscheint Saccharose als wesentlicher Ausgangsstoff ähnlich nachwachsend zu sein wie das von Clemens Liedel für die Vanillin-Herstellung genutzte Lignin. „Saccharose ist natürlich zunächst ein Lebensmittel“, räumt Oschatz ein, betont aber, „dass die Substanz als Elektrodenrohstoff dennoch deutlich nachhaltiger als etwa Lithium oder Kobalt ist.“ Ein weiteres Plus für die Umwelt bestehe darin, Materialien mit besonders großer Speicherdichte und langer Lebensdauer zu entwerfen.
Von den bisherigen Ergebnissen ist auch Markus Antonietti begeistert. Er leitet am Potsdamer Max-Planck-Institut für Kolloid- und Grenzflächenforschung die Abteilung Kolloidchemie, in der Clemens Liedel und Martin Oschatz forschen. Markus Anonietti hält es für denkbar, die Kosten je gespeicherter Kilowattstunde Strom mit den neuen Materialien für Superkondensatoren eines Tages deutlich senken zu können. Ziel müsse es jetzt sein, die Speicherdichte so weit zu steigern, dass die Energiespeicher eines Tages vielleicht sogar den Job bisheriger Batterien übernehmen können.
Und Antonietti hat noch eine Vision: „Irgendwann muss jeder Haushalt über einen eigenen Stromspeicher verfügen und im Sommer schon die Energie für den nächsten Winter laden.“ Das wären Energiemengen, die sich mit heutigen Batterien nicht nachhaltig speichern lassen. „Daher brauchen wir metallfreie, am besten nachwachsende Materialien“, so Antonietti. Er freut sich daher auch, wenn von Liedels Laboren manchmal ein Hauch Vanille herüberweht. Künftige Anwender solcher Speicher kämen freilich nicht in den Genuss des Dufts. In einer Batterie verarbeitet wäre das Vanillin chemisch gebunden – und damit geruchsneutral.
Auf den Punkt gebracht
- Derzeit gängige Batteriesysteme basieren auf Rohstoffen, mit denen ein nachhaltiger Ausbau der Speicherkapazitäten kaum möglich ist.
- Max-Planck-Forscher untersuchen daher Batteriekomponenten wie Elektroden, Elektrolyte oder Separatoren aus nachwachsenden Rohstoffen wie Vanillin, Chitosan und entsprechenden ionischen Flüssigkeiten.
- Sie versuchen auch die Speicherdichte und Lade- beziehungsweise Entladegeschwindigkeit von Superkondensatoren zu steigern, indem sie dafür Elektrodenmaterialien mit größerer Oberfläche und möglichst genau definierter Struktur entwickeln.