Forschungsbericht 2023 - Max-Planck-Institut für Pflanzenzüchtungsforschung
Pflanzliche Immunität: Neue Wirkprinzipien und Perspektiven für die Landwirtschaft
Bausteine für ein widerstandsfähiges pflanzliches Immunsystem
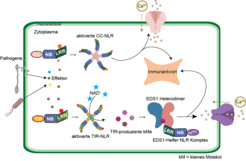
Wie Tiere verfügen Pflanzen über ein angeborenes Immunsystem, das Zellen vor Schaderregern schützt. Diese beiden unterschiedlichen Lebensformen setzen ähnlich organisierte Rezeptoren ein, um Krankheitserreger zu erkennen, Abwehrprogramme zu aktivieren und Krankheiten zu verhindern. Bei Säugetieren ist die angeborene Immunität nur eine erste Barriere gegen Infektionen. Bei Pflanzen hingegen ist die angeborene Immunität der einzige Mechanismus der aktiven Krankheitsbekämpfung. Daher wohl hat sich die Zahl und Vielfalt der Immunrezeptorfamilien in den Pflanzengenomen erheblich vergrößert. Wir untersuchen sogenannte Nukleotid-bindende/Leucin-reiche Repeat-Rezeptoren (NLR), die die Krankheitsresistenz von Wild- und Kulturpflanzen maßgeblich bestimmen. NLRs erkennen krankheitsfördernde Faktoren, Effektoren, die von Krankheitserregern in Wirtszellen eingeschleust werden (Abb. 1). Die NLR-Effektorerkennung löst den Tod der Wirtszellen an der Infektionsstelle aus, unterbricht so das Wachstum des Erregers und macht gleichzeitig umgebendes Gewebe auf die Krankheitsbedrohung aufmerksam.
Während die genetischen Grundlagen für die NLR-vermittelte Immunität in Pflanzen gut verstanden sind, blieb unklar, wie die NLR-Rezeptoren durch Pathogeneffektoren aktiviert werden. Unser Interesse gilt dem Verständnis der biochemischen Funktionsweise einer großen NLR-Rezeptorklasse, die sogenannte Toll-Interleukin-1-Rezeptor (TIR)-Domänen besitzt. Aktuelle Forschungsarbeiten mehrerer Arbeitsgruppen haben gezeigt, dass die N-terminalen "TIR"-Abschnitte dieser NLRs und anderer TIR-Domänen-Proteine in Pflanzen, Säugetieren und Bakterien als Enzyme arbeiten, die den zellulären Energiemetaboliten NAD+ hydrolysieren, um Botenstoffe auf Nukleotidbasis zu bilden [1].
Immunrezeptor-Baupläne für die Erkennung von Krankheitserregern und die Signalgebung
Fortschritte in der Kryo-Elektronenmikroskopie (Kryo-EM) ermöglichen es, Proteinkomplexe mit extrem hoher Auflösung sichtbar zu machen. Das war entscheidend für die Entschlüsselung der Funktionsweise von NLR-Rezeptoren, sowohl der inaktiven (ruhenden) als auch der durch Krankheitserreger aktivierten Formen. Sowohl bei Pflanzen als auch bei Säugetieren setzen sich aktivierte NLRs zu großen radförmigen Oligomeren zusammen, die nach einem ähnlichen Prinzip arbeiten, indem sie ihre N-terminalen Abschnitte umordnen, um Signale ins Zellinnere zu senden. Dies steuert dann Abwehr- und Zelltod Signalwege. Im Fall von zwei pflanzlichen TIR-NLRs führt die direkte Bindung eines Pathogeneffektors an einem Ende des Rezeptors zur Bildung eines 4-Protein-Oligomers, in dem die TIR-Domänen am anderen Rezeptorende ein NADase-Enzym bilden (Abb. 1; [2]). Diese Entdeckung, die wir zusammen mit unserem Kollegen Jijie Chai an der Universität Köln machten, lieferte Hinweise auf die nächsten Verteidigungsschritte, denn wir wussten, dass enzymatisch aktive TIR-NLRs auf eine kleine konservierte Familie von Nicht-NLR-Proteinen (die "EDS1-Familie") angewiesen sind, um die Wirtsresistenz und den Zelltod zu initiieren. Wir fanden, dass Paare der EDS1-Familie als Rezeptoren für bestimmte, von der TIR-Domäne erzeugte Nukleotidmoleküle dienen [3, 4]. Die Nukleotidbindung bewirkt, dass der EDS1-Komplex eine andere Gruppe von NLRs mit N-terminalen CCHeLo-Domänen aktiviert.
Letztere werden als Helfer-NLRs bezeichnet, da sie ausschließlich die Signalübertragung im Zellinneren übernehmen [1]. Wahrscheinlich arbeiten sie ähnlich wie die pathogenerkennenden CC-Domänen-NLRs (CC-NLRs), von denen bekannt ist, dass sie in der Zellhülle ein Oligomer mit Kalzium-durchlässiger Kanalaktivität bilden [1, 5]. Diese biochemischen Erkenntnisse ermöglichen es, die Vorgänge in Pflanzenzellen von der Erkennung des Krankheitserregers bis zur Blockierung der Infektion zu verfolgen und liefern ungeahnte Impulse für die Bekämpfung von Krankheiten bei Nutzpflanzen.
Entdeckung kleiner Moleküle zur Stimulierung des pflanzlichen Immunsystems
Gemeinsam mit der Arbeitsgruppe von Jijie Chai haben wir herausgefunden, dass pflanzliche TIR-NLR-NADasen eine Gruppe von ribosylierten Nukleotiden erzeugen, die die pflanzliche EDS1-Helfer-NLR-Abwehrmaschinerie durch Umorganisation der Proteinstruktur aktivieren (Abb. 1; [3, 4]). Diese von TIR-NLR-NADasen produzierten ribosylierten Nukleotide waren bisher unbekannt und ergänzen bekannte Nukleotid-basierte Botenstoffe in anderen Lebewesen [1].
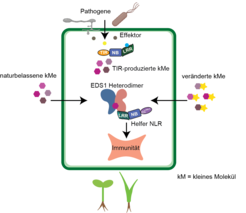
Unsere Studien zur Wirkweise konzentrierten sich auf die Modellpflanze Arabidopsis thaliana. Die Gene, die für die EDS1-Familie und ihre kooperierenden NLR-Helfer kodieren, sind im Genom aller samenbildenden Pflanzen vorhanden. Die Bindungsstellen für ribosylierte Nukleotide in EDS1-Paaren der entsprechenden Proteine von Nutzpflanzen wie Tomate, Gerste, Mais und Reis sind zudem konserviert (Abb. 2; [3, 4]). Daher repräsentieren diese immunstimulierenden Moleküle eine neue Klasse von Botenstoffen im Pflanzenreich.
Eine Perspektive für den Pflanzenschutz
Vielfältige Immunrezeptoren an der Oberfläche von Pflanzenzellen und im Zellinneren fangen Krankheitserreger nach ihrer Erkennung ab [1]. Tiefere Einblicke, wie diese Erreger-Überwachungssysteme pflanzenspezifische Immunsignale übermitteln, eröffnen neue Perspektiven für die Entwicklung von ökologisch unbedenklichem Pflanzenschutz. Wir gehen davon aus, dass natürliche oder synthetisch veränderte bioaktive Nukleotide, wenn sie wirksam in Pflanzenzellen eingebracht werden, die Erkennung von Krankheitserregern durch Rezeptoren umgehen und direkt zum Kern des Abwehrsystems vordringen können, um die Resistenz von Anfang an zu stimulieren. Daher ist die Entwicklung von Pflanzenschutzmitteln auf der Grundlage natürlicher Nukleotide eine attraktive Strategie für die Landwirtschaft. Die Entdeckung der neuartigen Nukleotidverbindungen als Informationsmoleküle in verschiedensten Lebensformen auf der Erde bietet zudem spannende Horizonte für die Forschung im Bereich des Immunstoffwechsels.













