Forschungsbericht 2023 - Max-Planck-Institut für Immunbiologie und Epigenetik
Leben nur zu zweit
Sicherheitsnetz für dosisempfindliche Gene
Jedes Gen hat zwei Allele, und zwar je eines von jedem Elternteil. Beide Allele sind in der Lage, mRNA zu produzieren, die das Rezept für die Herstellung funktioneller Proteine darstellt und die Zellen lebendig und gesund hält. Die Wissenschaft vermutet, dass das Vorhandensein von zwei Allelen für jedes Gen ein in die Zelle integriertes Reservesystem ist. Kommt es zum Rückgang der mRNA-Produktion oder zu einer Mutation eines Allels auf einem der beiden Chromosomen, dient das Allel auf dem zweiten Chromosom als Backup. Dieses ist in der Lage, ausreichend mRNA zu produzieren, um so den Ausfall auszugleichen (Abb. 1). Diese Redundanz macht uns Menschen weitgehend resistent gegen die Auswirkungen rezessiver Mutationen.
Eine Klasse von dosisempfindlichen Genen, die sogenannten haploinsuffizienten Gene, stellen jedoch eine Besonderheit dar. Diese Gene sind auf die kontinuierliche Transkription von zwei intakten Allelen angewiesen. Wenn die Expression auch nur eines Allels eines haploinsuffizienten Gens beeinträchtigt ist, kann dies zu Krankheiten führen. Ein Beispiel dafür ist das MECP2-Gen: Zu hohe oder zu niedrige Dosen dieses Gens verursachen Entwicklungsstörungen des Gehirns: MECP2-Duplikationssyndrom und Rett-Syndrom. Deshalb vermuteten wir, dass Zellen spezielle molekulare Schutzmechanismen entwickelt haben, um die Produktion der mRNA dieser besonderen Klasse von Genen zu schützen.
Mein Labor hat kürzlich genau einen solchen Mechanismus entdeckt [1]. Wir nutzten dafür ein Modellsystem, bei dem wir zwei genetisch weit voneinander entfernte Mäusestämme kreuzten. Die so entstandenen hybriden Mäuse tragen dadurch genetische Fingerabdrücke, dank derer wir feststellen konnten, ob die mRNA in der Zelle vom mütterlichen oder väterlichen Chromosom oder von beiden Chromosomen generiert wurde. Im Normalzustand der Zelle fanden wir, dass die meisten haploinsuffizienten Gene mRNA von beiden Allelen produzierten. Als wir jedoch den Chromatinregulator MSL2 mithilfe der CRISPR/Cas9-Technik entfernten, beobachteten wir, dass eine Untergruppe dieser haploinsuffizienten Genen nur noch von einem Allel mRNA produzierte. Einige der Gene, die nach dem Verlust von MSL2 nur noch „monoallel“ exprimiert werden, sind dafür bekannt, Krankheiten wie das Dias-Logan-Syndrom, das schwere Intelligenzminderungen aufzeigt, zu verursachen (Abb. 2).
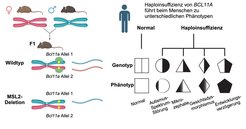
Haploinsuffiziente Gene reagieren sehr empfindlich auf die Gendosis, also auf die Menge der produzierten mRNA. Beide Allele müssen aktiv sein, um die für eine normale Entwicklung erforderliche Menge an mRNA bereitzustellen. Ist dies nicht der Fall, treten Krankheiten auf. Tatsächlich zeigen Mäuse ohne MSL2 verschiedene Entwicklungsfehlbildungen und starben noch im Mutterleib oder kurz nach der Geburt.
Neuer Schlüssel zur Erforschung von Krankheiten
Unsere Ergebnisse haben wichtige medizinische Implikationen. In einer vorangegangenen Studie hat mein Labor in Zusammenarbeit mit Medizinern gezeigt, dass Mutationen in MSL3, einem wichtigen Partnerprotein von MSL2, zu einer neurologischen Entwicklungsstörung führen, die als Basilicata-Akhtar-Syndrom bekannt ist [2]. Betroffene mit diesem Syndrom zeigen Entwicklungsverzögerungen, geistige Behinderungen und Muskelschwäche.
Die Tatsache, dass MSL2 haploinsuffiziente Gene daran hindern kann, eines ihrer Allele auszuschalten, war für unser Labor eine faszinierende Entdeckung. Wir konnten nun zum ersten Mal zeigen, dass ein chromatinassoziiertes Protein die Transkription eines spezifischen Allels direkt beeinflussen kann. Dies widerspricht der herkömmlichen Ansicht der Transkriptionsregulation, die davon ausgeht, dass die Aktivität beider Allele eines Gens normalerweise gleichmäßig reguliert wird.
Unsere Forschung hat nicht nur gezeigt, dass das Protein MSL2 bei bestimmten haploinsuffizienten Gene dafür sorgt, dass beide Allele aktiv sind, sondern wir haben auch untersucht, wie diese Aktivität reguliert wird. MSL2 kann an bestimmte Regulationselemente der DNA, wie Promotoren und Verstärker, binden. Es zeigte sich, dass Gene, die normalerweise „biallelisch“ exprimiert werden, nach dem Verlust von MSL2 die Expression eines Allels verlieren. Diese Gene weisen einen einzigartigen Chromatinzustand auf: Das weiterhin aktive Allel, das seine Expression beibehält, zeigt eine Bindung an die Transkriptionsmaschinerie, was dazu führt, dass das Chromatin offenbleibt und die Produktion von mRNA von diesem Allel gefördert wird. Das andere Allel hingegen wird komplett inaktiv. Die Transkriptionsmaschinerie bindet nicht mehr und stattdessen ist sein Promotor sogar durch DNA-Methylierung gekennzeichnet. Diese Methylierung bewirkt, dass das Chromatin sich an dieser Stelle schließt und die Aktivität des Allels unterdrückt wird.
Ein neues Verständnis der Genexpression
Die Entdeckung, dass Genexpression auf allelspezifische Weise reguliert werden kann, fügt unserem Verständnis der Geneaktivität eine ganz neue Ebene hinzu. Anstatt nur zu betrachten, wie ein Chromatinfaktor die Gesamtmenge der mRNA eines Gens beeinflussen kann, müssen wir auch den allelspezifischen Ursprung dieser mRNA berücksichtigen. Kommt die gesamte mRNA von beiden Allelen oder nur von einem? Und von welchem genau? Und beeinflusst ein bestimmter Chromatinfaktor die Auswahl? Welche biologischen Auswirkungen könnte das haben? Wir vermuten, dass es eine völlig neue Ebene der Genregulation noch zu entdecken gibt. Allerdings müssen die Labore, um diese neue Ebene erkennen zu können, hybride Tiermodelle nutzen, die eine genetische Unterscheidung zwischen den mütterlichen und väterlichen Allelen erlauben. Aktuell sind die meisten derzeit verwendeten Labortiere jedoch durch Inzucht einzelner Mausstämme erzeugt und können daher nicht für diesen Zweck verwendet werden. Wir sind aber zuversichtlich, dass sich dieser Umstand schnell ändern wird, indem die Forschung in diesem Feld zunehmend auf hybride Tiere umsteigt.













