Gendefekte ohne Folgen
mRNA fehlerhafter Gene schiebt Kompensationsmechanismus an
Viele Krankheiten werden durch Gendefekte verursacht. Ihr Schweregrad kann jedoch zwischen einzelnen Patienten variieren, sodass auch milde Verlaufsformen auftreten können. Wissenschaftler des Max-Planck-Instituts für Herz- und Lungenforschung in Bad Nauheim haben nun einen molekularen Mechanismus entschlüsselt, der für dieses Phänomen verantwortlich ist. Demnach stellt die mRNA des defekten Gens sicher, dass verwandte Gene aktiviert werden und diese den Ausfall kompensieren. Die Forscher hoffen, diesen Mechanismus für therapeutische Ansätze nutzen zu können.

Defekte Gene sind für eine Reihe teilweise ernsthafter Erkrankungen verantwortlich. Ein Beispiel ist die Mukoviszidose, deren schwere Symptome auf ein defektes Protein zurückzuführen sind. Diese Fehlbildung wird wiederum durch einen Defekt im kodierenden Gen verursacht. Bei vielen Erkrankungen sind die verantwortlichen Gene mittlerweile identifiziert.
Mit Experimenten versuchen Forscher häufig die Funktion eines Gens zu entschlüsseln, indem sie die Gene verändern. Dies geschieht beispielsweise durch das Einfügen von Mutationen. Eine solche Veränderung wirkt sich jedoch nicht immer auf den Organismus aus. Tierversuche zeigen zum Beispiel häufig, dass nach einem genetischen Ausschalten von Genen der erwartete Effekt nicht auftritt. Forscher sprechen in diesem Fall von einem fehlenden „Phänotypen“. Die Ursachen hierfür sind größtenteils unbekannt. Eine mögliche Erklärung ist, dass bei einem Ausfall eines Genprodukts seine Aufgaben von anderen, ähnlich wirkenden Proteinen übernommen werden. Unklar ist jedoch, ob und über welche weiteren molekularen Mechanismen der Ausfall einzelner Gene kompensiert wird.
Verwandte Gene gleichen Ausfall aus
Wissenschaftler des Max-Planck-Instituts für Herz- und Lungenforschung in Bad Nauheim haben jetzt neuartige Werkzeuge wie CRISPR eingesetzt, um eine solche molekulare Maschinerie zu entschlüsseln. Demnach mildern verwandte Gene, die nun aktiver sind, die Folgen des Gendefekts ab. „Anhand von Daten aus früheren Studien gingen wir davon aus, dass ein Defekt in einem Gen zu aktiveren verwandten Genen führen könnte. Außerdem werden nun deren Genprodukte gebildet. Diese dem eigentlichen Protein ähnlichen Proteine übernehmen dann verstärkt dessen Aufgaben“, erklärt Erstautor Mohamed El-Brolosy aus der Abteilung von Didier Stainier. „Hinter dieser genetischen Kompensation steht eine komplexe molekulare Maschinerie.“ Stainiers Gruppe konnte nun die komplexen Prozesse anhand von Experimenten an Mäusen und Zebrafischen entschlüsseln.
Die Bad Nauheimer Wissenschaftler haben Zebrafische mit Mutationen in verschiedenen Genen untersucht. „Wir haben zunächst viele verschiedene Mutationen in bestimmten Genen betrachtet und festgestellt, dass nicht alle gleich sind", sagt El-Brolosy. Diejenigen, die zu weniger Abnormalitäten neigten, hatten etwas gemeinsam: Die Forscher stellten fest, dass in diesen Mutanten mehr mRNA anderer Mitglieder der Genfamilien gebildet werden. Zur Erklärung: Die mRNA transportiert die Information des Genes in die Zelle, wo das Protein gebildet wird. „Um herauszufinden, ob der Auslöser eventuell fehlerhaft gebildete Proteine sein könnte, schleusten wir funktionelles Protein in die Mutanten ein. Dies hatte allerdings keinen Einfluss. Daraus konnten wir schließen, dass die Regulation nicht auf der Proteinebene stattfindet“, so El-Brosoly.
Es zeigte sich, dass die mRNA in Mutanten ohne auftretende Abnormalitäten, immer instabil war. „In diesen Fällen wurde die mutierte mRNA schneller abgebaut“, sagt El-Brolosy. Aus dieser und anderen Beobachtungen schlussfolgern die Bad Nauheimer Forscher, dass mRNA auf einer zweiten Ebene signalisiert. „Die mutierte mRNA ist gleichzeitig das Signal an andere, nicht mutierte Gene, die Aufgabe zu übernehmen.“
Ohne mRNA fehlt Signal für Kompensation
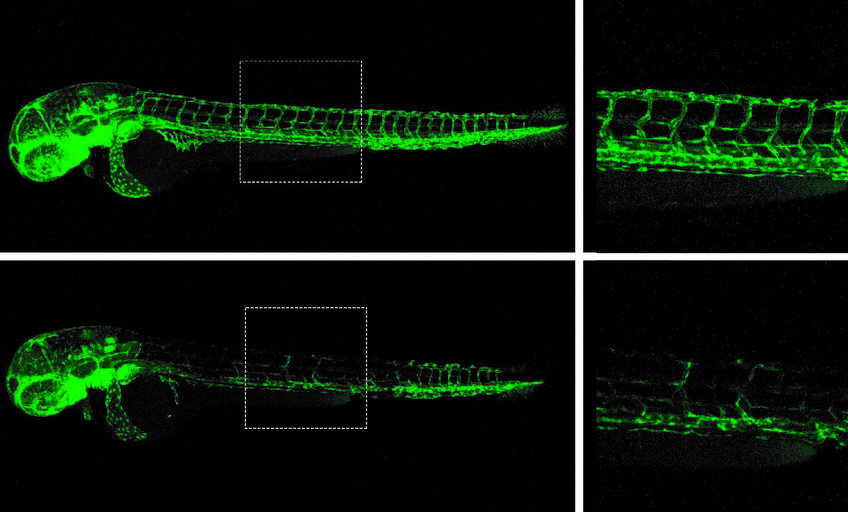
Die Forscher untersuchten diese Hypothese anschließend mit einem besonderen Kniff: Ein zusätzlicher gentechnischer Eingriff verhinderte, dass weiterhin mutierte mRNA erzeugt werden konnte. „Da es nun keine mutierte mRNA mehr gab, fehlte der Signalgeber für die anderen Gene. Infolgedessen sahen wir bei diesen Tieren keine Kompensation“, so El-Brolosy. Mit offensichtlich dramatischen Effekten: Zum Beispiel war die Entwicklung von Blutgefäßen in Zebrafischembryonen mit einer einschlägigen Mutation nur gestört, wenn die mutierte mRNA fehlte. Wenn die mutierte mRNA vorhanden war, entwickelten sich die Gefäße normal, da die verwandten Gene aktiver waren. „Die molekulare Maschinerie, die normalerweise gewährleistet, dass nur einwandfreie Proteine gebildet werden, hat aus unserer Sicht noch eine zweite wesentliche Funktion: Sie hilft, verwandte Gene als Alternative zum defekten Gen zu aktivieren. Dadurch wird der Gendefekt kompensiert“, sagt Stainier.
Bei einer Reihe von Krankheiten könnte dieser Mechanismus einzelne Patienten davor bewahren, schwerere Symptome zu entwickeln. Stainiers Gruppe plant deshalb, der Sache weiter auf den Grund zu gehen. Hierzu will die Gruppe einzelne Patienten mit unterschiedlicher klinischer Manifestation vergleichen. Mit einer solchen Analyse hoffen Wissenschaftler, Gene zu identifizieren, die für therapeutische Ansätze verwendet werden könnten. Eine solche Therapie sollte aus Sicht Stainiers allerdings darauf abzielen, die Widerstandsfähigkeit des Patienten vor dem Entstehen von Mutationen zu stärken, statt diese zu korrigieren. „In dieser Studie haben wir auch neue und wichtige Informationen über nicht vorhersehbare Folgen von Manipulationen am Genom, dem Genom-Editing, gewonnen. Wir plädieren deshalb dafür, bevor Richtlinien zum Genom-Editing überhaupt diskutiert werden, dessen Konsequenzen zunächst intensiv zu erforschen“, betont Stainier.