Proteinvorrat für den Anfang eines neuen Lebens
Zytoplasmatisches Gitter in der Eizelle versorgt den frühen Embryo mit Proteinen
Wenn Säugetiere Nachwuchs bekommen, investieren sie viel. Anders als bei Fisch oder Frosch kann sich der Embryo nicht von allein entwickeln. Er muss sich in die Gebärmutter einnisten und wird dort mit allem Lebenswichtigen versorgt. Bis dies geschieht, wird der frühe Embryo von der Eizelle versorgt. Sie stellt unter anderem wichtige Proteine bereit. Forschende um Melina Schuh am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften haben nun gemeinsam mit Göttinger Kolleginnen und Kollegen aufgeklärt, wie Eizellen Proteine auf Vorrat halten. Ihre Experimente liefern auch wertvolle Erkenntnisse dazu, wie Fehler bei der Proteinspeicherung zu Unfruchtbarkeit führen können. Eine entscheidende Rolle dabei spielen Strukturen der Eizelle, die der Wissenschaft seit über 60 Jahren Rätsel aufgeben.

Für viele Paare lässt das Elternglück auf sich warten. Für einige bleibt der Kinderwunsch sogar unerfüllt. Die Ursachen sind vielfältig und können bei der Frau wie beim Mann liegen. Bei Frauen nehmen Unfruchtbarkeit oder verminderte Fruchtbarkeit mit dem Alter zu. Aber auch genetische Mutationen können dazu beitragen.
Analysen des Erbguts von unfruchtbaren Frauen weltweit zeigten, dass eine der häufigsten genetischen Ursachen für weibliche Unfruchtbarkeit Mutationen in bestimmten Genen sind. Diese enthalten die Baupläne für das Protein PADI6 und den Proteinkomplex Subcortial Maternal Complex, kurz SCMC. Doch welche Rolle gerade diese Proteine bei Unfruchtbarkeit spielen, war bislang unklar.
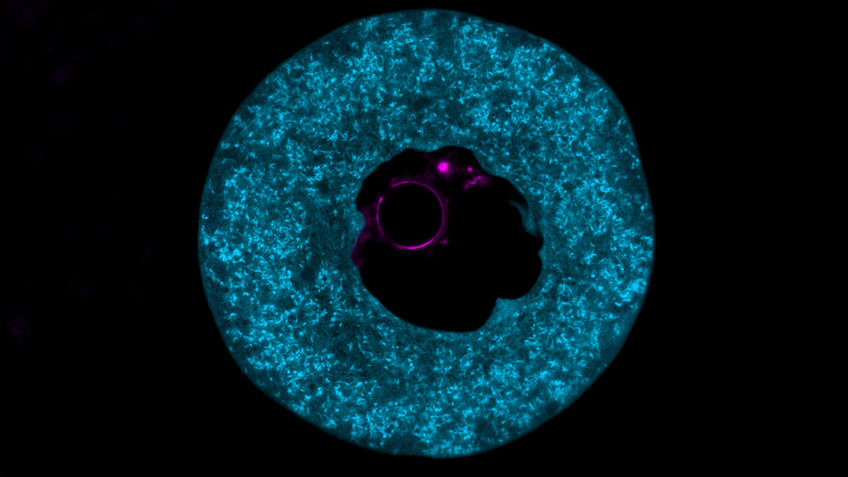
Proteinspeicher für den frühen Embryo
Forschende um Melina Schuh haben jetzt mithilfe bildgebender Verfahren sichtbar gemacht, dass PADI6 und SCMC Hauptbestandteile von Strukturen sind, die das Innere der Eizelle ausfüllen. „Die Forschungswelt rätselt seit Jahrzehnten, welche Funktion und Zusammensetzung diese Struktur hat, die wir als zytoplasmatische Gitter bezeichnen“, erklärt Max-Planck-Direktorin Schuh.
Entfernten die Forschenden in Mäuse-Eizellen die PADI6- und SCMC-Proteine, ging das zytoplasmatische Gitter verloren – mit fatalen Folgen. „Mäuse-Eizellen, denen zytoplasmatische Gitter fehlten, fehlten auch die Proteine, die der frühe Embryo benötigt. Die Entwicklung des Embryos kam kurz nach der Befruchtung zum Stillstand“, so die Zellbiologin. „Wir vermuteten daher, dass die zytoplasmatischen Gitter als Proteinspeicher dienen könnten.“
Proteine auf Vorrat in der Eizelle zu speichern ist keineswegs trivial. Denn Eizellen sind von Geburt an in den Eierstöcken eines weiblichen Säugetiers angelegt und bleiben dort Monate oder sogar viele Jahre funktionsfähig. Entsprechend lange müssen Eizellen ihre Proteine auf Vorrat halten, ohne dass sie abgebaut oder zu einem falschen Zeitpunkt aktiv werden.
Die Forschenden untersuchten im nächsten Schritt, welche Proteine in den zytoplasmatischen Gittern enthalten sind. In Kooperation mit Gruppen um Henning Urlaub und Juliane Liepe vom Max-Planck-Institut ermittelten sie mithilfe von Massenspektrometrie und Bioinformatik das genaue Proteininventar der Gitter. Die Ergebnisse zeigen, dass sich die zytoplasmatischen Gitter mit vielen Proteinen verbinden, die für die Embryonalentwicklung entscheidend sind. „Unsere Ergebnisse liefern starke Hinweise darauf, dass unsere Vermutung stimmt: Die zytoplasmatischen Gitter sind die Proteinspeicher der Eizelle und versorgen den frühen Embryo mit lebenswichtigen Proteinen“, sagt Schuh.
PADI6- und SCMC-Proteine übernehmen Speicherfunktion

Wie sie weiter herausfanden, übernehmen die PADI6- und SCMC-Proteine bei der Proteinvorratshaltung die Aufgabe, Proteine für die Frühentwicklung des Embryos zu sammeln und zu speichern. „Das erklärt, warum Embryos kurz nach der Befruchtung aufhören, sich zu entwickeln, wenn diese Proteine fehlen oder ihre Funktion nicht erfüllen können“, sagt Ida Jentoft, Erstautorin der Studie. „Uns hat dann interessiert, ob sich ein defekter Proteinspeicher ersetzen lässt, wenn beispielsweise durch Genmutationen PADI6 und SCMC fehlen.“
In Versuchen gelang es dem Team, in wachsende Eizellen von Mäusen die fehlenden Gitterproteine wieder künstlich einzubringen. Mit diesem Ansatz ließe sich möglicherweise auch in fehlerhaften menschlichen Eizellen das zytoplasmatische Gitter neu aufbauen. „Dies könne ein neuer vielversprechende Ansatz sein, um Unfruchtbarkeit zu behandeln, die auf Mutationen der PADI6- und SCMC-Gene beruhen“, meint Jentoft.
Gefrorene Eizellen unter der Lupe
Auf die Frage, warum es so viele Jahrzehnte dauerte, die Funktion der rätselhaften Gitterstrukturen in der Eizelle zu entschlüsseln, haben Schuh und Jentoft eine kurze Antwort: die Größe der Eizelle und die fehlenden Methoden. Eizellen sind die Giganten unter den verschiedenen Zelltypen in Säugetieren. Was sie für das Speichern von Proteinen prädestiniert, erschwert den Blick in ihr Innenleben. „Die große methodische Herausforderung war es, die Eizellen für unsere verwendeten Bildgebungsverfahren – hochauflösende Lichtmikroskopie und Kryo-Elektronentomografie (Kryo-ET) – zugänglich zu machen. Letztere ermöglicht es, molekulare Strukturen der Eizelle in 3D unter fast natürlichen Bedingungen zu untersuchen. Das war bislang nicht möglich“, so die Max-Planck-Direktorin. Zum Durchbruch bei diesem Verfahren verhalf dem Team ein bereits bewährter Trick aus der Reproduktionsmedizin.
Für die Kryo-ET müssen Zellen zunächst schockgefroren werden. Dabei machten sich die Forschenden zunutze, dass Kliniken menschliche Eizellen für künstliche Befruchtung routinemäßig einfrieren, um sie zu lagern. Um die Eizellen während des Einfrierens zu schützen, verwenden die Kliniken Kryo-Schutzmittel. „Wir hatten die Idee, dieselben Kryoprotektiva zu verwenden, um das erforderliche schnelle Einfrieren der Eizellen zu erreichen“, berichtet Rubén Fernández-Busnadiego von der Universitätsmedizin Göttingen. „Mit dieser Technik können wir die zytoplasmatischen Gitter in der Eizelle untersuchen und beginnen, ihre Struktur im Detail zu entschlüsseln“, ergänzt Schuh. Von den neuen Techniken erhoffen sich die Forschenden neben zukünftigen neuen Therapieansätzen wichtige Fortschritte in der Eizellforschung.