Krebserregende Bakterien auf frischer Tat ertappt
Ein Forschungsteam zeigt, wie ein Gift von E. coli-Bakterien Zellen zu Krebs transformiert

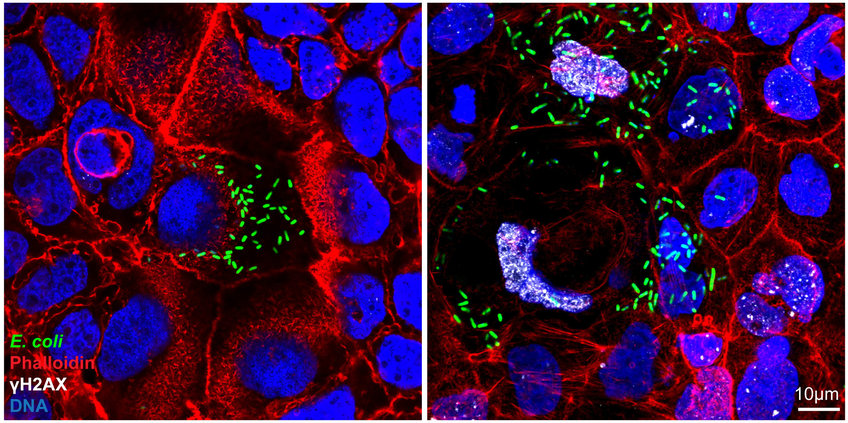
Die Immunfluoreszenzfärbung zeigt, dass genotoxische Colibactin-produzierende E. coli-Bakterien (grün) DNA-Schäden (angezeigt durch das Vorhandensein des DNA-Reparaturproteins γH2AX, weiß) und Megalozytose (abnorme Vergrößerung der Zellen) verursachen (rechts). Dies wird bei Zellen, die mit dem für die Colibactin-Synthese defekten Mutantenstamm (E. coli ΔclbR) infiziert sind, nicht beobachtet (links). Phalloidin (rot) färbt die Aktinfilamente der Zellen und die DNA ist blau dargestellt.
Mehr als zwei Drittel der Darmkrebspatientinnen und -patienten tragen Colibactin-produzierende E. coli-Stämme in ihrem Darm und die Inzidenz steigt in westlichen Gesellschaften immer weiter an. Obwohl viele epidemiologischen Hinweise einen Zusammenhang zwischen Infektionen mit bestimmten Bakterienarten und der Entstehung von Krebs nahelegen, ist es schwer direkte Beweise zu liefern, die großangelegte Präventionsansätze rechtfertigen könnten. Das Forscherteam um Professor Meyer lieferte erst vor kurzem den ersten definitiven Beweis für einen solchen Zusammenhang – indem sie zeigten, dass Colibactin in den Wirtszellen einen ganz spezifischen genetischen Fingerabdruck hinterlässt, der sich in einer bestimmten Unterart von Darmtumoren wiederfindet.
Nun ist es Ihnen erstmalig gelungen, den Prozess der Transformation im Labor nachzuverfolgen, indem Sie sogenannte Organoide als Modell herangezogen haben. Bei dieser neuen Technologie werden Dickdarm-Schleimhautzellen in der Petrischale in Form von dreidimensionalen, hohlen „Mini-Organen“ gezüchtet. Mit ihrer Hilfe können Forschende zelluläre Prozesse im Darm an lebenden Zellen direkt beobachten. Die Organoide werden aus adulten Stammzellen aus dem Darm generiert, die dort für die ständige Regenerierung der Darmschleimhaut verantwortlich sind. Vor der Entwicklung der Organoid-Technologie war man zur Untersuchung des Infektionsgeschehens weitgehend auf Zelllinien angewiesen, welche bereits krebsähnliche Eigenschaften aufweisen und somit keine Untersuchung früher Ereignisse in der Krebsentstehung zulassen.
Das Team setzte ihre Organoide drei Stunden lang Colibactin-produzierenden E. coli-Bakterien aus, um zu testen, ob diese einen dauerhaften Effekt auf die Darmzellen haben. Dies war bereits ausreichend um Veränderungen auszulösen, die für Darmkrebs charakteristisch sind. Zunächst begannen die Zellen sich schneller als normal zu vermehren – das bekannteste Merkmal von Krebszellen. Besonders bemerkenswert war allerdings, dass die Zellen nach der Infektion, anders als normale Stammzellen, ohne den Wachstumsfaktor „Wnt“ im Nährmedium überleben konnten.
Wachstumsfaktor regt zur Teilung an
Dieser Wachstumsfaktor wird an der Basis der sogenannten Darmkrypten, in direkter Umgebung der Darmstammzellen produziert, und regt diese zur Teilung an. „Im Normalzustand wird unkontrolliertes Wachstum dadurch verhindert, dass die Zellen aufhören sich zu teilen sobald sie diese Wnt-produzierende Nische verlassen und sich zu spezialisierten Darmzellen entwickeln. Durch den kontinuierlichen Nachschub von weiteren Zellen werden sie immer weiter bis zur Oberfläche der Krypten geschoben, wo sie schließlich abgeschilfert werden,“ erklärt Michael Sigal, der mit seiner Gruppe an der Studie beteiligt war und inzwischen sein eigenes Labor an der Charité – Universitätsmedizin Berlin leitet um den Zusammenhang zwischen Stammzellfunktion und Krebsentstehung im Darm weiter zu untersuchen. „Das gleiche Phänomen kann auch im Organoid beobachtet werden: Die Organoid-Zellen benötigen kontinuierlich Wnt, um sich zu vermehren; ohne diesen Wachstumsfaktor differenzieren sie genau wie im gesunden Darm aus, verwandeln sich in spezialisierte Zellen und sterben kurze Zeit später ab.“ Wenn es Zellen gelingt, sich unabhängig von dem Wnt-Signal zu vermehren, entsteht unkontrolliertes Wachstum, eine Vorstufe von Krebs.
Die Sequenzierung des Erbguts der Wnt-unabhängigen Organoide ergab, dass die DNA zahlreiche Mutationen aufwies, darunter auch grobe strukturelle Veränderungen, bei denen ganze Abschnitte von Chromosomen umstrukturiert oder verlorengegangen waren. „Überraschenderweise fanden wir keine Mutationen in Genen, die direkt am Wnt-Signalweg beteiligt sind, und von denen man weiß, dass sie zu Krebs führen wenn man eine solche Mutation geerbt hat,“ erläutert Amina Iftekhar, Erstautorin der Publikation. „Stattdessen fanden wir Mutationen im p53-Signalweg. Dieser wichtige Tumor-Suppressor wird oft als „Wächter des Genoms“ bezeichnet und bisher gab es nur ganz wenige Studien, die darauf hindeuteten, dass p53 auch bei der Wnt-Abhängigkeit eine Rolle spielen könnte.“
Mutationen im p53-Signalweg im frühen Stadium
Laut Thomas Meyer passen diese Erkenntnisse gut zu dem, was man aus großangelegten Krebs-Sequenzierungsstudien weiß: „Darmkrebs kann offensichtlich durch verschiedene Mechanismen entstehen. In den Fällen, die durch chronische Entzündungen wie Kolitis oder Morbus Crohn ausgelöst werden – und das sind gerade die, bei denen Colibactin-produzierende E. Coli-Bakterien eine bedeutende Rolle spielen – finden sich in der Tat bereits im frühen Stadium p53-Mutationen.“ Die beobachteten großen chromosomalen Restrukturierungen, wiederum, finden sich in den meisten Darmkrebsfällen.
Laut Meyer eröffnen sich damit weitere wichtige Perspektiven: „Wir wunderten uns, warum der genetische Fingerabdruck von Colibactin nur in einem geringen Anteil von circa zehn Prozent der Darmtumoren zu finden ist, obwohl die Mehrheit der Patienten Colibactin-produzierende E. coli-Bakterien in ihrem Darm tragen. Unsere neuen Ergebnisse legen nahe, dass dieser charakteristische Fingerabdruck im Erbgut dadurch entsteht, dass die von Colibactin induzierten Querverbindungen zwischen zwei DNA-Strängen vom zelleigenen Reparatursystem präzise ausgeschnitten und bestmöglich repariert werden. Wenn dieser Prozess jedoch fehlschlägt, oder das Reparatursystem von einem Übermaß an geschädigten Stellen überfordert wird, scheint es zur Umstrukturierung ganzer Chromosomenabschnitte zu kommen. Relikte solcher fehlgeschlagenen Reparaturversuche finden sich häufig im Genom von Darmtumoren, was wiederum darauf hindeutet, dass die krebserregende Wirkung von Colibactin weitaus größer sein mag, als dies die zehn Prozent der Fälle mit dem präzisen genetischen Fingerabdruck von Colibactin vermuten lassen.“